
| A. | 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护 | |
| B. | 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原电池的电极材料分别为Mg和Al,则Mg一定做负极 | |
| D. | 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小 |
分析 A、锡的金属性小于铁、锌的金属性大于铁,所以镀层破损后?形成原电池,镀锡铁更容易被腐蚀;
B、金属铜是活泼电极,电解硫酸溶液在阴极上是硫酸中的氢离子发生得电子的还原反应;
C、在原电池中,发生失电子氧化反应的电极是负极;
D、正逆反应的活化能大小是相同的.
解答 解:A、镀锡铁桶和镀锌铁桶在镀层破损后,铁和锡、铁和锌构成了原电池,其中镀锡的铁桶中,铁为原电池的负极,更容易被腐蚀,故A错误;
B、用铜作电极电解稀硫酸,金属铜是活泼电极,电解硫酸溶液在阴极上是硫酸中的氢离子发生得电子的还原反应,发生总反应为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑,故B正确;
C、原电池的电极材料分别为Mg和Al,若是氢氧化钠作电解质,此则Mg不做负极,做正极,故C错误;
D、可逆反应升高温度,吸热方向化学反应速率增大程度大,故D错误.
故选B.
点评 本题涉及金属的腐蚀和防护、电解池的工作原理以及原电池的构成、温度对反应速率的影响等方面知识,属于综合知识的考查,难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. |  除去粗盐溶液中的不溶物 | B. | 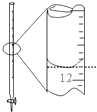 记录滴定终点读数为12.20ml | ||
| C. | 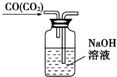 除去CO气体中的CO2气体 | D. | 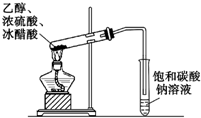 乙酸乙酯制备演示实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑥ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
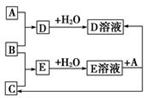 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③ | B. | ③④①② | C. | ①②④③ | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com