
【题目】Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol–1。
CH3OH(g) ΔH=-90.8 kJ·mol–1。
(1)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270 ℃三种温度下合成甲醇的规律。
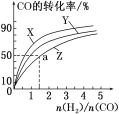
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_______。
Ⅱ.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
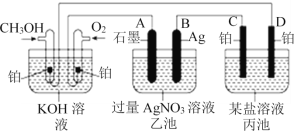
(2)乙池中A(石墨)电极的名称是______。
(3)通入CH3OH的电极的电极反应式为______。
(4)乙池中反应的化学方程式为_________
(5)当乙池中B(Ag)极的质量增加5.4 g时,甲池中理论上消耗O2 ________mL(标准状况),此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
【答案】270 ℃ 阳极 CH3OH-6e– + 8OH– = 6H2O + CO32– 4AgNO3 + 2H2O![]() 4Ag + O2↑ + 4HNO3 280 B
4Ag + O2↑ + 4HNO3 280 B
【解析】
三条曲线中,在曲线Z对应的温度下CO转化率最小,合成甲醇的反应是放热反应,温度越高,CO的转化率越小,所以Z曲线对应的温度最高,为270℃;在燃料电池中,通入燃料的电极为负极,发生失电子的反应,通入氧气的电极为正极,发生得电子的反应。燃料电池最为电源,乙池中,与正极相连的A极(石墨电极)为阳极,那么B极(银电极)为阴极,丙池中,C极为阳极,D极为阴极,相应得电极反应式即可书写出来。
(1)在曲线Z对应的温度下CO转化率最小,合成甲醇的反应是放热反应,温度越高CO的转化率越小,故Z曲线对应的温度最高,为270℃;
(2)燃料电池作为电源,通入燃料的电极为负极,通入氧气的电极为正极,A电极与正极相连,所以A电极(石墨)为阳极;
(3)通入CH3OH的电极作为负极,电极反应式为:CH3OH-6e– + 8OH– = 6H2O + CO32–;
(4)乙池中,A极(石墨电极)的电极反应式为:2H2O-4e–=O2↑+ 4H+,B极的电极反应式为:4Ag++4e–=4Ag↓,电解质溶液为硝酸银溶液,所以乙池中反应的化学方程式为:4AgNO3 + 2H2O![]() 4Ag + O2↑ + 4HNO3;
4Ag + O2↑ + 4HNO3;
(5)当乙池中B(Ag)极的质量增加5.4 g时,n(Ag)=5.4g/108g·mol-1=0.05mol,n(e–)=0.05mol,又O2~4e–,所以n(O2)=0.0125mol,标况下,V(O2)=0.0125×22.4=0.28L=280ml所以甲池中理论上消耗O2 的体积为280ml;丙池某电极上析出1.60 g某金属,C极为阳极,D极为阴极,所以只能是D极析出金属,而NaCl作为电解质溶液时不会析出金属,根据转移的n(e–)=0.05mol及Mg~2e–、Cu~2e–、Ag~e–,析出的金属的质量分别为0.60g、1.60g、5.40g,所以丙池中的某盐溶液可能是CuSO4溶液,选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
| |
①配制0.l0mol/L NaOH溶液 | ②除去CO中的CO2 |
| |
③苯萃取碘水中的I2,分出水层后得到I2的操作 | ④记录滴定终点读数为12.20mL |
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
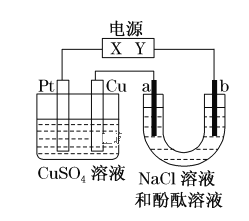
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
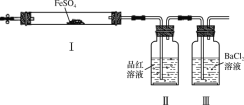
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C.酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好
D.使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
![]()
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能燃烧,其产物一定为二氧化碳和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工程师为了从腐蚀废液(含有Cu2+、Fe2+、Fe3+)中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

(1)请写出上述实验中加入或生成的有关物质的化学式。
①=__________,② __________,③__________,④__________,⑤__________,⑥__________。
(2)请写出相关反应的化学方程式:______,_____________,__________,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com