
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
分析 (1)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(2)根据弱电解质电离吸收热量;
(3)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小.
解答 解:(1)50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为三次实验的平均值3.33℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.33℃=1391.9J,即1.3919kJ,
所以实验测得的中和热△H=-$\frac{1.3919kJ}{0.025mol}$=-55.7 kJ•mol-1;
故答案为:-55.7 kJ•mol-1;
(2)若用等浓度的醋酸与NaOH溶液反应,醋酸电离要吸收能量,造成放出的热量偏小,因为中和热为负值,所以测得的中和热偏大;
故答案为:偏大;用醋酸代替盐酸,醋酸电离要吸收热量,中和热为负值,所以造成测得中和热偏大;
(3)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小,因为中和热为负值,所以测得的中和热偏大;
故答案为:偏大.
点评 本题主要考查了中和热的测定,注意掌握中和热的测定方法,明确中和热为“-”,在比较大小是要考虑符号,题目难度中等.


科目:高中化学 来源: 题型:选择题
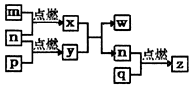 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: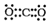 | D. | z、w含有的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率低 | |
| C. | t1至t2时刻该反应的速率为3mo1•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、豆浆、碳素墨水均可发生丁达尔现象 | |
| B. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 | |
| C. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| D. | 鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | 实验1在前6min的平均反应速率υ(SO2)=0.2 mol•L-1•min-1 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | x=1.6,y=0.2,t<6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和Mg | B. | Mg和Al | C. | Al 和 Si | D. | SiO2和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
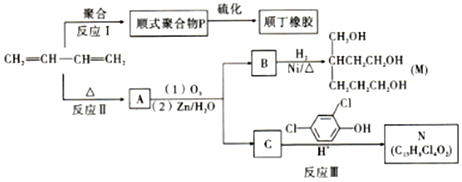
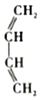 +
+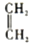 $\stackrel{△}{→}$
$\stackrel{△}{→}$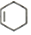
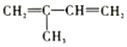 的名称是2-甲基-1,3-丁二烯.
的名称是2-甲基-1,3-丁二烯. b.
b. c.
c.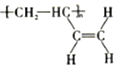
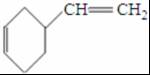 ;反应III的化学方程式是
;反应III的化学方程式是 ;1molB完全转化成M所消耗H2的质量是6g.
;1molB完全转化成M所消耗H2的质量是6g.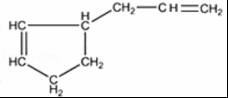 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淘汰和禁止黄标车(高污染排放车辆)上路行驶,可减少雾霾天气 | |
| B. | 煤的干馏、液化和气化均为化学变化 | |
| C. | 可利用乙醇、次氯酸钠等消毒剂的氧化杀菌作用防控病毒 | |
| D. | 开发和利用新能源代替化石燃料,符合中国在世界环境日的主题--“践行绿色生活” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液:K+、Cu2+、NO3-、SO42- | |
| B. | 某无色透明溶液:Fe2+、ClO-、SiO32-、Na + | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+、K+、NO3-、Cl- | |
| D. | 0.1mol/LNaHCO3溶液:Na+、A13+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com