
【题目】下列说法中,正确的是( )
A.SO2的摩尔质量是64g
B.18g H2O在标准状况下的体积是22.4L
C.在标准状况下,20mL NH3 与60mL O2所含的分子数比为1:3
D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰( MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
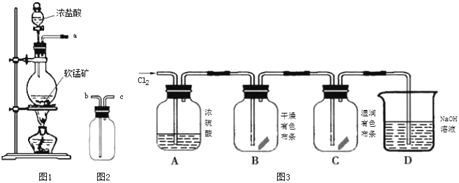
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是____。
(2)收集氯气应将图1导管的a接口与图2导管的_____________接口连接(填“b”或“c)。
(3)已知氯气中含有HCl杂质,可用______________除去。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是_______________________________________________________________________。
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色。由此得出的结论是_____________________________________________________________________。
(6)写出C中反应的化学方程式:_________________________________________________。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是______________ (双项选择,填序号)。
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K+ , Na+ , Fe3+ , Mg2+ , Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )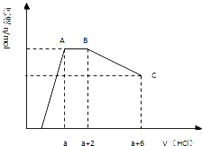
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣ , CO32﹣ , SiO32﹣ , AlO2﹣ , K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
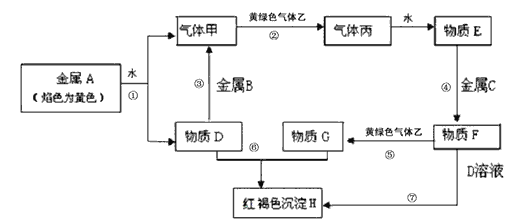
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A:_____ B:_____ F:______ 丙:______
(2)说出黄绿色气体乙的一种用途:____________________。
(3)若除去F溶液中含有的少量G,需加入______,实验室检验G中所含的金属离子时,常在G的溶液中加入_______________溶液。
(4)反应①的离子方程式为_______________________________________。
(5)反应⑦涉及的化学方程式有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下: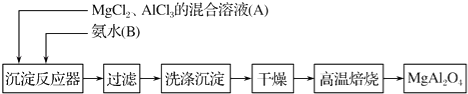
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为 .
(2)判断流程中沉淀是否洗净所用的试剂是 .
(3)在25℃下,向浓度均为0.01mol/L的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式: .
【已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Al(OH)3]=3×10﹣34】
(4)将Mg、Al组成的9.9g混合物投入一定量稀硝酸中,恰好完全反应,共收集到还原产物NO气体6.72L(标准状况),向反应后的溶液中加入4mol/L的Na0H溶液300mL时,则形成沉淀的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL﹣1 NaOH溶液中逐滴加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示. 
(1)酸碱中和滴定时,用到的仪器有酸式滴定管、碱式滴定管、铁架台(带蝴蝶夹)、 .
(2)a点(横坐标为10)所示溶液中,溶质是 , 溶液中c(Na+)、c(A)、c(H+)、c(OH﹣)从大到小的顺序为 , 其中c(Na+)c(A﹣)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)c(A﹣)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A﹣)c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是 .
(6)以下滴定操作会导致V(HA)偏大的是 . A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质发生化学反应时,下列选项在反应前后肯定不发生变化的是( )
①原子总数 ②分子总数 ③电子总数 ④物质的种类 ⑤物质的总质量
A.①②③B.①③⑤C.②③⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,Cl-、Br-、I-的物质的量分别为2mol、3mol、4mol;若通入一定量的氯气,使得溶液中Br-物质的量变为1mol,则通入氯气的物质的量为
A.1molB.2molC.3molD.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学学习小组模拟工业烟气脱硫(SO2)。
(1)甲组采用如下装置脱硫(部分装置略)。

① CaO脱硫后的产物是_________。
② b中品红很快褪色,说明脱硫效果不好。下列措施能提高脱硫效果的是_____。
ⅰ. 加快SO2气体流速
ⅱ. 将堆集在一起的CaO平铺在整个玻璃管
ⅲ. 加热a,脱硫效果可能会更好
③ 小组拟通过CaO的增重评价其脱硫能力。需要测量的数据是_______。
(2)乙组选用AgNO3溶液脱除SO2 。

现象:通入SO2,立即生成大量白色沉淀A。
对白色沉淀A的成分进行探究,提出假设:
假设1:发生了氧化还原反应,依据是AgNO3溶液中含有O2、![]() 等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
假设2:发生了复分解反应,依据是SO2与水生成酸,能与AgNO3溶液发生复分解反应。
实验探究:
① 取沉淀A,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,无明显变化。
② 取______,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,产生沉淀。
实验证明“假设1”不成立。
③ 为进一步确认“假设2”,向A中加入浓HNO3,立即产生红棕色气体。加入浓硝酸的目的是________;经确认,反应后混合液存在SO![]() 。
。
实验证明“假设2”成立。
④ 产生沉淀A的化学方程式是_________。AgNO3溶液具有良好的脱硫能力,但因其价格高,未能大规模使用。
(3)丙组用NaClO脱除SO2,用1 L 0.1 mol/L 的NaClO溶液最多可以吸收标准状况下的SO2_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com