
常温下,将20.0g 14.0%的NaCl溶液跟30.0g 24.0%的NaCl溶液混合,得到密度为1.15g•cm﹣3的混合溶液.
(1)该混合溶液的质量分数为.
(2)该混合溶液的物质的量浓度是3mol•L﹣1
(3)在1000g水中溶解 mol NaCl才能使其浓度与上述混合溶液的浓度相等.
| 溶液中溶质的质量分数及相关计算;物质的量浓度的相关计算. | |
| 分析: | (1)根据质量分数的公式计算; (2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度; (3)根据c= |
| 解答: | 解:(1)20.0g质量分数为14.0%的KNO3溶液中溶质的质量m1=20.0g×14.0%=2.8g;30.0g质量分数为24.0%的KNO3溶液溶质的质量m2=30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为 故答案为:20%; (2)混合溶液的密度为1.15g/cm3,NaCl的质量分数为20%,则混合后NaCl的物质的量浓度c= 故答案为:3.93mol/L. (3)设应溶解的NaCl的物质的量为x, 则有 解得:x=4.27 mol 故答案为:4.27. |
| 点评: | 本题考查了溶液的质量分数、物质的量浓度的计算,计算物质的量浓度时要注意单位的换算. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g) 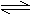 2C(g) △H<0的平衡移动图形,影响平衡移动的原
2C(g) △H<0的平衡移动图形,影响平衡移动的原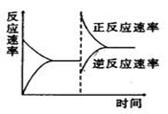 因是 ( )
因是 ( )
A.升高温度,同时加压。
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂;
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)===AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
将100g溶质质量分数为16%的盐酸与100g溶质质量分数为16%的NaOH溶液混合后,滴入几滴紫色石蕊试液,则最终溶液颜色是()
| A. | 蓝色 | B. | 紫色 | C. | 红色 | D. | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2mL试样于试管中,而后进行如下实验,其中不能达到目的是()
| A. | 加入少量盐酸,观察现象 | B. | 加入澄清石灰水,观察现象 | |
| C. | 加入氯化钡溶液,观察现象 | D. | 通适量CO2气体,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | 某物质中含有一种元素,则该物质一定是纯净物 | |
| B. | 金刚石和石墨之间的转变一定是化学变化 | |
| C. | 不同物质其相对分子质量一定不同 | |
| D. | 不同的原子可相互组合成复杂的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣═RO4﹣+2F﹣+H2O从而可知在RO3n﹣中,元素R的化合价是()
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列金属冶炼的反应原理,错误的是
A.2 NaCl(熔融)
NaCl(熔融)  2Na+Cl2 B.Mg
2Na+Cl2 B.Mg O+H2
O+H2 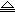 Mg+H2O
Mg+H2O
C .Fe3O4+4CO
.Fe3O4+4CO  3Fe+4CO2 D.2HgO
3Fe+4CO2 D.2HgO 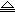 2Hg+O2
2Hg+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com