
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
分析 (1)利用盖斯定律通过①×2+②+2×③计算化学反应的焓变即可;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算CO反应的物质的量,根据CO反应的物质的量计算其转化率,转化率=$\frac{消耗量}{起始量}$×100%;
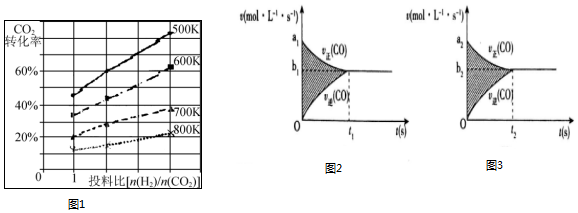
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,据此答题;
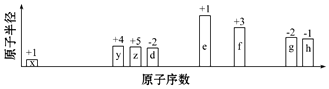
(4)反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2KJ/mol的v-t图象如图2所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图3中浓度变化比图2中浓度变化小;
(5)根据元素守恒可写出化学方程式,根据硫酸的性质分析该工艺的缺点.
解答 解:(1)①2H2(g)+CO(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
由盖斯定律可知,通过①×2+②+2×③可得所求反应方程式,则△H=2△H1+△H2-2△H3=2×(-90.7kJ•mol-1)-23.5kJ•mol-1+2×41.2kJ•mol-1=-122.5kJ•mol-1,
故答案为:-122.5;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%;
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使CO2的转化率增大的越显著,
故答案为:升高温度,CO2的转化率降低;温度越低,增大投料比使CO2的转化率增大的越显著;
(4)反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2KJ/mol的v-t图象如图2所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图3中浓度变化比图2中浓度变化小,则分析选项得到:a1>a2,b1>b2,t1<t2,两图中阴影部分面积图3阴影部分面积更小,左图阴影部分面积更大,选择①③⑦⑩,故选D,
故答案为:D;
(5)根据元素守恒可知硫酸氢甲酯再和甲醇反应生成二甲醚的化学方程式为CH3OSO3H+CH3OH→CH3OCH3+H2SO4,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可知该工艺的缺点是浓H2SO4腐蚀设备或有硫酸废液产生,
故答案为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4;浓H2SO4腐蚀设备或有硫酸废液产生.
点评 本题考考查了热化学方程式和盖斯定律计算应用,转化率的计算,影响平衡的因素分析判断,题目涉及的知识点较多,综合性较强,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮化镓是由主族元素与副族元素形成的化合物 | |
| B. | 镓元素比铝元素金属性弱 | |
| C. | 氮化镓中氮元素显+3价 | |
| D. | 氮原子最外层比镓原子最外层多2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+) | |
| B. | c(K+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1 | |
| D. | c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
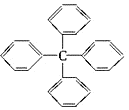 甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代,则可得到新分子(如图). 对该分子的描述不正确的是( )
甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代,则可得到新分子(如图). 对该分子的描述不正确的是( )| A. | 分子式为C25H20 | B. | 属于芳香烃 | ||
| C. | 该物质的一氯代物有3种 | D. | 所有碳原子可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
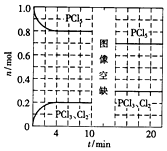 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:| A. | 0~4min的平均速率v(Cl2)=0.05mol/(L•min ) | |
| B. | 10min时改变的条件是分离出一定量的PCl5 | |
| C. | 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ | |
| D. | 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com