
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体, D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。各物质之间的转换关系如下图,部分生成物省略。请回答下列问题:
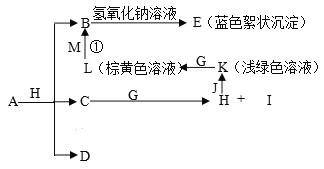
(1)写出A的化学式__________________,C的电子式______________________,
D的结构式______________________________。
(2)将22.4L(标准状况)D气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中除了Na+外,还大量存在的离子是______________________________。
(3)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式___________________________________________________________。
(4)检验化合物K中阳离子的实验方法是______________________________________
(5)写出反应K+G→L的化学方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是( )

A. 1molA在碱性条件下水解消耗2molNaOH
B. A在一定条件下可与4molH2发生加成反应
C. 符合题中A分子结构特征的有机物只有1种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
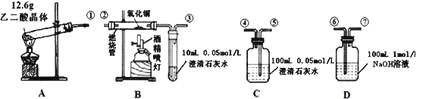
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
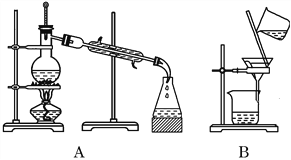
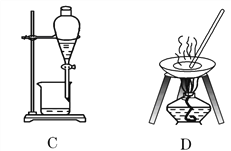
I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙______________________;
(2)氯化钠溶液中分离出氯化钠____________________;
(3)分离植物油和水____________________;
(4)分离酒精和水____________________;
(5)氯化钠溶液中分离出水____________________。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的有__________
A.酒精 B.苯
②分液漏斗在使用前必须先________________;
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的_______端口放出,有机层应由分液漏斗的________端口放出(此问填“上”或者“下”) ;
(2)蒸馏
①冷凝装置中冷凝水应该_______口进(填“上”或“下”)
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,氢氧化钙固体在水溶液中达到溶解平衡:Ca(OH)2 (s) ![]() Ca2++2OH-,向其中加入以下物质,恢复到室温,Ca(OH)2固体减少的是( )
Ca2++2OH-,向其中加入以下物质,恢复到室温,Ca(OH)2固体减少的是( )
A. CH3COONa B. AlCl3 C. NaOH D. CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢化钠(NaH) 是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。根据信息完成下列各空:
(1)氢化钠的电子式为_____________________________。
(2)氢化钠与水反应的化学方程式为_____________________,反应的氧化剂为___________。该反应过程中,被破坏的化学键有_____________(填序号,下同),形成的化学键有______________。
①离子键 ②极性共价键 ③非极性共价键
II.现有短周期元素X 形成的单质A与NaOH溶液反应,有如下转化关系: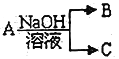 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)常温常压下,若A 为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为________________________________________________;
(2)若A 为金属单质,C 为气体,则A 与NaOH 溶液反应的离子方程式为_____________________________;A 最高价氧化物的水化物与NaOH 溶液反应的离子方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com