
分析 (1)二氧化硅为光导纤维主要原料;
(2)晶体硅为良好的半导体材料;
(3)玻璃中含有二氧化硅,二氧化硅能够与氢氟酸反应生成四氟化硅和水;
(4)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,以此计算;
(5)铝与氢氧化钠反应生成四羟基合铝酸钠和氢气;氧化铝与氢氧化钠反应生成四羟基合铝酸钠;
(6)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据Na和氢气之间的关系式计算.
解答 解:(1)光导纤维的主要成分是二氧化硅;
故答案为:二氧化硅;
(2)晶体硅为良好的半导体材料是目前应用最多的太阳能电池的光电转化材料是硅;
故答案为:硅;
(3)玻璃中含有二氧化硅,二氧化硅能够与氢氟酸反应生成四氟化硅和水,化学方程式:SiO2+4HF=SiF4↑+2H2O;
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,由反应可知,物质的量比为1:2,质量比为1×60:2×12=5:2,
SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,则C为氧化剂,也是还原剂,由电子守恒及原子守恒可知,1molC作氧化剂与2molC作还原剂转移电子相等,则氧化剂和还原剂物质的量之比为1:2,
故答案为:5:2,1:2;
(5)铝与氢氧化钠反应生成四羟基合铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O=2[Al(OH)4]-+3H2↑;氧化铝与氢氧化钠反应生成四羟基合铝酸钠,离子方程式:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
故答案为:2Al+2OH-+2H2O=2[Al(OH)4]-+3H2↑;Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(6)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据方程式知,0.1molNa完全反应生成V(H2)=2n(Na).Vm=2×0.1mol×22.4L/mol=4.48L>1.12L,
故选b.
点评 本题为综合题,考查了硅及其化合物性质及用途,离子方程式的书写,有关方程式的计算,明确相关物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有银镜生成,说明淀粉没有水解 | |
| C. | 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性 | |
| D. | 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5gNaCl溶解于1L水中配成的溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将22.4L的HCl气体溶于水,制成1L溶液,其浓度为1mol/L | |
| C. | 配制480ml 1.0mol/L的NaOH 溶液需要NaOH 固体20.0g | |
| D. | 中和100ml 1 1mol/L 的H2SO4溶液,需要NaOH 4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
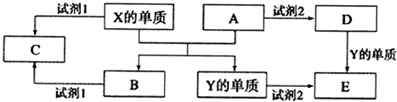
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| C. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3+Al3+ | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
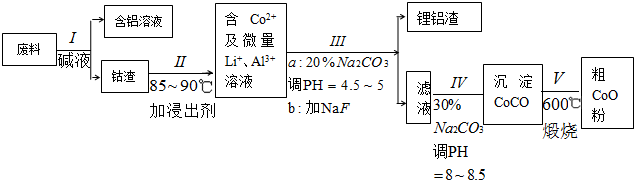
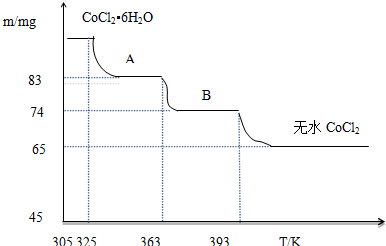
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com