
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A. 3.8×104kJ·mol-1 B. -3.8×104kJ·mol-1
C. 3.4×104kJ·mol-1 D. -3.4×104kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星──土卫六。科学家对探测器发回的数据进了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的叙述正确的是 ( )
A. 碳氢化合物的通式为CnH2n+2 B. 石油的主要成分是碳氢化合物
C. 乙炔是含碳量最高的碳氢氧化物 D. 碳氢氧化物中的化学键都是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
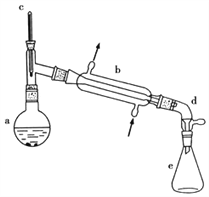

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在在生活生产中有着重要应用.
(1)粗制![]() 晶体中常含有杂质
晶体中常含有杂质![]() .
.
①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是 ______ .
,下列物质最好选用的是 ______ .
A. ![]()
![]()
![]() 氯水
氯水![]()
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的 ______ .
,调整溶液pH可选用下列中的 ______ .
A.NaOH ![]()
![]()
![]()
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,先生成 ______ 沉淀
混合溶液中逐滴加入氨水,先生成 ______ 沉淀![]() 填化学式
填化学式![]() ,生成该沉淀的离子方程式为 ______
,生成该沉淀的离子方程式为 ______ ![]() 已知
已知![]() 时
时![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]() ______
______ ![]()
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是 ______ ,产生该现象的原因是
可以观察到的现象是 ______ ,产生该现象的原因是![]() 用离子方程式表示
用离子方程式表示![]() ______ 已知:Ksp[
______ 已知:Ksp[![]() ]=4.0x10-38。
]=4.0x10-38。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
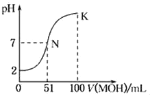
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
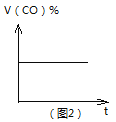
【题目】下列关于化学反应的图像的说法不正确是 ( )
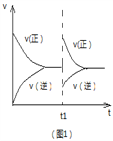
A. 图1可表示反应2NO2![]() N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
B. 图2可表示CO(g)+2H2(g)![]() CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
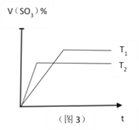
C. 图3可表示反应2SO2 +O2![]() 2SO3 ,温度T1>T2,反应为吸热反应。
2SO3 ,温度T1>T2,反应为吸热反应。
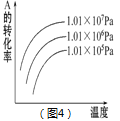
D. 图4可表示反应mA(g)+nB(g)![]() pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c 为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
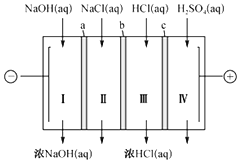
A. b、c 分别依次为阳离子交换膜、阴离子交换膜
B. 通电后Ⅲ室中的Cl-透过c 迁移至阳极区
C. Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D. 电池总反应为4NaCl+6H2O![]() 4NaOH+4HCl+2H2↑+O2↑
4NaOH+4HCl+2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
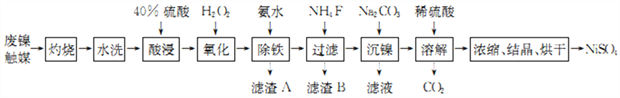
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为______________.
(2)实验中眼睛注视_____________________,直至滴定终点.判断到达终点的现象是_________.
(3)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A. 滴定前仰视刻度,滴定后俯视刻度_________.
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水_________.
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com