
【题目】CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:
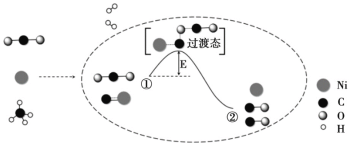
下列说法不正确的是
A.Ni 在该反应中做催化剂,参与化学反应
B.①→②吸收能量
C.①→②既有碳氧键的断裂,又有碳氧键的形成
D.合成气的主要成分为 CO 和 H2
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.0.5molNO与0.5molO2充分反应后分子数少于0.75NA
B.5.6gFe在发生氧化还原反应时失去电子数为0.2NA
C.1.0L0.1mol/LAl2(SO4)3溶液中阳离子数目为0.2NA
D.agC2H4和C3H6混合物完全燃烧时消耗O2的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提供几组常见的实验装置示意图,下列有关叙述正确的是
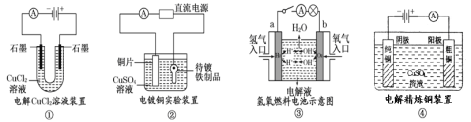
A.装置①中阳极上有无色无味气体冒出
B.装置②中的铜片应与直流电源的负极相连
C.装置③中,若电解液为KOH溶液,则电极a的反应式:H2-2e-+2OH-=2H2O
D.装置④阳极减少的质量一定等于阴极增加的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q
查看答案和解析>>
科目:高中化学 来源: 题型:
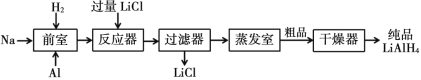
【题目】氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
Ⅰ. 施莱兴格(Schlesinger)法
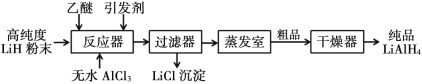
Ⅱ.高压合成法
请根据题中信息回答以下问题:
(1)Schlesinger 中的反应器需要附加电磁搅拌器,目的是________。
(2)Schlesinger 的反应器中发生的化学反应方程式是________。
(3)采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是________。
(4)为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是________。
(5)已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由________。
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有________。
(7)使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )
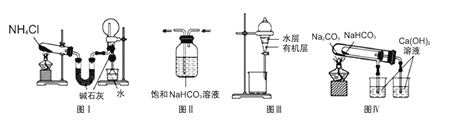
A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,它是无色透明的单斜晶体,熔点48℃。硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应原理为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。
Ⅰ.为了从废定影液中提取 AgNO3,设计如下实验流程。
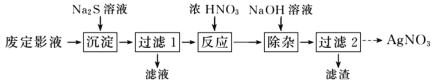
(1)“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是________。
(2)“反应”步骤中会生成淡黄色固体,该反应的化学方程式为________。
(3)“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、________、________、干燥。
Ⅱ.下图是实验室模拟工业制备 Na2S2O3 的装置图。
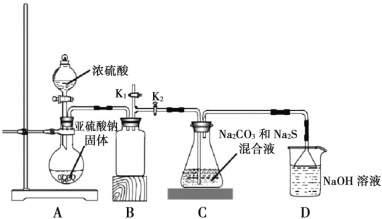
依据图示回答下列问题:
(4)装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是________,装置 B 的作用是________。
(5)分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是________。
(6)设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法________。
(7)硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+,理论上处理1mol Cr2O72-需要 Na2S2O3的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①正丁醇沸点:117.2℃,正丁醛沸点:75.7℃;②正丁醇合成正丁醛的反应:![]() ,装置如图。下列说法不正确的是
,装置如图。下列说法不正确的是

A.为防止产物进一步氧化,应将适量Na2Cr2O7酸性溶液逐滴加入正丁醇中
B.向分馏出的馏出物中加入少量金属钠,可检验其中是否含有正丁醇
C.当温度计1示数为90~95℃,温度计2示数在76℃左右时收集产物
D.向分离所得的粗正丁醛中,加入无水CaCl2固体,过滤,蒸馏,可提纯正丁醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氯气通入氢氧化钾溶液中,反应后得到氯化钾,次氯酸钾,氯酸钾的混合溶液,经测定ClO与ClO3离子的物质的量的浓度之比为1:2,则氯气与氢氧化钾反应时,被还原的氯原子与被氧化的氯原子的物质的量之比为( )
A. 10:3B. 11:3C. 2:3D. 4:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com