
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- K+[Al(OH)4]- OH- | D. | NO3- Ba2+ K+ Cl- |
分析 加入铝粉能放出氢气的溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,
A.铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应;
B.碳酸氢根离子与氢离子、氢氧根离子反应;
C.氢氧根离子与氢离子反应,[Al(OH)4]-与氢离子反应;
D.四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:加入铝粉能放出氢气的溶液中存在大量氢离子或氢氧根离子,
A.NH4+与氢氧根离子,CO32-与氢离子反应,在溶液中一定不能大量共存,故A错误;
B.HCO3-与氢离子、氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.OH-与氢离子反应,[Al(OH)4]-与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.NO3-、Ba2+、K+、Cl-之间不发生反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
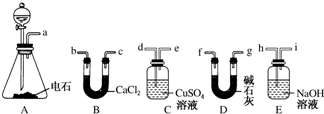
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:3 | B. | 3:2 | C. | 1:3 | D. | 3:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径:r(Z)<r(R) | |
| C. | R的氯化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
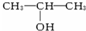 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.| A. | ①③⑥ | B. | ③⑤⑥ | C. | ②③④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2NA | |
| B. | 标准状况下,11.2 L CH3OH中含有的共价键数目为2.5NA | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
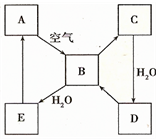 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com