
常温下,对于1L0.005mol·L-1硫酸表述中正确的是
| A.由水电离出的c(H+)=1.0×10-12mol·L-1 |
| B.加水稀释后,溶液中所有离子的浓度均减少 |
| C.2c(H+)= c(SO42-)+ c(OH-) |
| D.滴加稀氨水使pH=7,则c(NH4+)=" 2" c(SO42-) |
AD
解析试题分析:硫酸是强酸,能完全电离,则H2SO4=2H++SO42—中氢离子浓度与硫酸浓度之比等于系数之比,即c(H+)=0.005mol·L-1×2 =0.01mol/L,由于水是极弱电解质,硫酸能抑制水的电离,水电离出的氢离子可忽略不计,则溶液中c(H+)=0.01mol/L,由于常温下水的离子积为1.0×10-14,则溶液中c(OH-)=Kw/ c(H+)=1.0×10-12 mol/L,由于溶质不能电离出氢氧根离子,氢氧根离子全部来自水的电离,则水电离出c(OH-)= 1.0×10-12 mol/L,由于H2O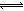 H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
考点:考查水溶液中的离子浓度大小关系,涉及物质的量浓度、强酸电离方程式中氢离子与强酸的系数之比的应用、水的电离、水的离子积、溶液中氢氧根离子浓度的计算、强酸溶液中水电离出的氢离子浓度的计算、强酸溶液中存在的离子、强酸稀释后离子浓度大小变化情况、电荷守恒原理及其应用、溶液的酸碱性与pH等。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:单选题
利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
下列有关上述过程的说法错误的是
| A.NaOH溶液吸收SO2制得Na2SO3溶液的离子方程式:2OH-+SO2=SO32-+H2O |
| B.当吸收液呈中性时,溶液中的离子浓度满足:c(Na+)=2c(SO32-)+c(HSO3-) |
C.吸收液吸收SO2的过程中,pH与 的大小成反比 的大小成反比 |
| D.HSO3-在阳极放电时的电极反应式:HSO3-+H2O-2e-=S042- +3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于常温下0.0lmol/L的氨水,下列叙述正确的是
| A.c(H+)+c(NH4+)=c(OH-) |
| B.与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3· H2O)="0.02" mol·L-1 |
| C.与等体积等浓度的盐酸混合后所得溶液显酸性 |
| D.由H2O电离出的c(H+)=1.0×10-12 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,实验室有0.01mol·L-1醋酸,下列叙述正确的是
| A.c (CH3COO-) + c (OH-)=" 0.01" mol·L-1 |
| B.与等体积pH = 12的氨水混合后所得溶液显碱性 |
| C.加入少量醋酸钠固体后所得溶液中c (CH3COO-)减小 |
| D.与等体积0.01 mol·L-1NaNO3溶液混合后有:c (NO3-) =" c" (CH3COO-)+c (CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知HF酸性强于CH3COOH,常温下有下列三种溶液。有关叙述不正确的是
| A.②、③混合后:C(H+)=C(F-)+C(CH3COO-)+ c(OH-) |
| B.①、②等体积混合后:c(CH3COO-)>c(Na+)>C(H+)>c(OH-) |
| C.中和相同体积的②、③,需消耗相同体积的① |
| D.向②加入NaF固体,CH3C00H电离平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将20mL 0.1 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸混合,在所得到的溶液中离子浓度的关系错误的是( )
| A.c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| B.c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.2c(OH-)—2c(H+)=c(NH4+)—c(NH3·H2O) |
| D.c(H+)=c(NH3·H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐? 其溶液显 性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)(H3PO2)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com