
”¾ĢāÄæ”æ°±ŹĒ»ÆѧŹµŃéŹŅ¼°»Æ¹¤Éś²śÖŠµÄÖŲŅŖĪļÖŹ£¬Ó¦ÓĆ¹ć·ŗ”£
(1)ŅŃÖŖ25”ꏱ£ŗN2£Øg£©+O2£Øg£©![]() 2NO£Øg£© ”÷H1£½+183kJ£Æmol
2NO£Øg£© ”÷H1£½+183kJ£Æmol
2H2£Øg£©+O2£Øg£©£½2H2O£Ø1£© ”÷H2£½-571.6kJ£Æmol
4NH3£Øg£©+5O2£Øg£©£½4NO£Øg£©+6H2O£Ø1£© ”÷H3£½-1164.4kJ£Æmol
ŌņN2£Øg£©+3H2£Øg£©![]() 2NH3£Øg£© ”÷H£½________kJ£Æmol
2NH3£Øg£© ”÷H£½________kJ£Æmol
(2)ŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠŗĻ³É°±·“Ó¦£¬ĘšŹ¼Ķ¶ĮĻŹ±ø÷ĪļÖŹÅضČČēĻĀ±ķ£ŗ
N2 | H2 | NH3 | |
Ķ¶ĮĻI | 1.0mol/L | 3.0mol/L | 0 |
Ķ¶ĮĻII | 0.5mol/L | 1.5mol/L | 1.0mol/L |
¢Ł°“Ķ¶ĮĻI½ųŠŠ·“Ó¦£¬²āµĆ“ļµ½»ÆŃ§Ę½ŗāדĢ¬Ź±H2µÄ×Ŗ»ÆĀŹĪŖ40£„£¬Čō°“Ķ¶ĮĻII½ųŠŠ·“Ó¦£¬ĘšŹ¼Ź±·“Ó¦½ųŠŠµÄ·½ĻņĪŖ________£ØĢī”°ÕżĻņ”±»ņ”°ÄęĻņ”±£©”£
¢ŚL£ØL1”¢L2£©”¢XæÉ·Ö±š“ś±ķŃ¹Ēæ»ņĪĀ¶Č”£ČēĶ¼±ķŹ¾LŅ»¶ØŹ±£¬ŗĻ³É°±·“Ó¦ÖŠH2£Øg£©µÄĘ½ŗā×Ŗ»ÆĀŹĖęX
µÄ±ä»Æ¹ŲĻµ”£
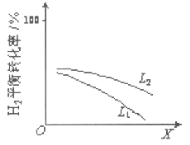
iX“ś±ķµÄĪļĄķĮæŹĒ_________£¬
iiÅŠ¶ĻL1”¢L2µÄ“󊔹ŲĻµ£¬²¢¼ņŹöĄķÓÉ£ŗ_____________”£
”¾“š°ø”æ-92.2 ÕżĻņ ĪĀ¶Č L1<L2£¬µ±ĪĀ¶ČŅ»¶ØŹ±£¬Ń¹ĒæŌ½“ó£¬Ę½ŗā×Ŗ»ÆĀŹŌ½“ó
”¾½āĪö”æ
£Ø1£©ŅŃÖŖ25”ꏱ£ŗ¢ŁN2£Øg£©+O2£Øg£©2NO£Øg£©”÷H=+183kJ/mol
¢Ś2H2£Øg£©+O2£Øg£©2H2O£Øl£©”÷H=©571.6kJ/mol
¢Ū4NH3£Øg£©+5O2£Øg£©4NO£Øg£©+6H2O£Øl£©”÷H=©1164.4kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉ¢Ł+¢Ś”Į![]() ©
©![]() ”Į¢ŪµĆ£¬N2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H=£Ø+183©571.6”Į+”Į1164.4£©kJ/mol =©92.2kJ/mol£»
”Į¢ŪµĆ£¬N2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H=£Ø+183©571.6”Į+”Į1164.4£©kJ/mol =©92.2kJ/mol£»
£Ø2£©¢Ł°“Ķ¶ĮĻ¢ņ½«°±ĘųĶźČ«×Ŗ»Æµ½ÓŅ±ß£¬ŌņÓėĶ¶ĮĻ¢ńĶźČ«ĻąĶ¬£¬ĪŖĶźČ«µČŠ§Ę½ŗā£¬ĖłŅŌ°“Ķ¶ĮĻ¢ņ½ųŠŠ·“Ó¦Ę½ŗāŹ±H2µÄÅضČŅ²ĪŖ3.0mol/L”Į£Ø1©40%£©=1.8mol/L£¬ĖłŅŌ°“Ķ¶ĮĻ¢ņ½ųŠŠ·“Ó¦£¬ĘšŹ¼Ź±·“Ó¦½ųŠŠµÄ·½ĻņĪŖÕżĻņ£»
¢Śi”¢ÓÉĶ¼æÉÖŖ£¬XŌ½“ó£¬ĒāĘų×Ŗ»ÆĀŹŌ½µĶ£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņĒāĘų×Ŗ»ÆĀŹ¼õŠ”£¬ŌņX±ķŹ¾ĪĀ¶Č£»
ii”¢ÓÉN2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H£¼0£¬ĪĀ¶Čøߣ¬ĒāĘų×Ŗ»ÆĀŹŠ”£¬Ń¹Ēæ“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ĒāĘų×Ŗ»ÆĀŹ“ó£¬Ķ¼ÖŠµČĪĀ¶ČŹ±L2¶ŌÓ¦µÄĒāĘų×Ŗ»ÆĀŹ“ó£¬ŌņŃ¹ĒæL1£¼L2”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒą³öÓŚĄ¶¶ųŹ¤ÓŚĄ¶£¬”°Ēą”±ÖøµÄŹĒµåĄ¶£¬ŹĒČĖĄąŹ¹ÓĆĄśŹ·ÓĘ¾ĆµÄČ¾ĮĻÖ®Ņ»£¬ĻĀĮŠĪŖ“«Ķ³ÖʱøµåĄ¶µÄ¹ż³Ģ£ŗ

ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A. µåĄ¶µÄ·Ö×ÓŹ½ĪŖC16H10N2O2
B. ½žÅŻ·¢½Ķ¹ż³Ģ·¢ÉśµÄ·“Ó¦ĪŖČ”“ś·“Ó¦
C. ßÅßį·ÓµÄ±½»·ÉĻµÄ¶žĀČ“śĪļÓŠ4ÖÖ
D. 1 molßÅßį·ÓÓėH2¼Ó³ÉŹ±æÉĻūŗÄ4 mol H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄÕĻÄĢŲĮŠŌĄķŹĒ×ŌČ»½ēŅ»ĢõÖŲŅŖµÄ»ł±¾ŌĄķ,ĻĀĮŠŹĀŹµÄÜÓĆĄÕĻÄĢŲĮŠŌĄķ½āŹĶµÄŹĒ
A. NO2ĘųĢåŹÜŃ¹Ėõŗó£¬ŃÕÉ«ĻȱäÉīŗó±äĒ³
B. ¶Ō2HI(g) ![]() H2(g)£«I2(g)Ę½ŗāĢåĻµ¼ÓŃ¹£¬ŃÕÉ«ŃøĖŁ±äÉī
H2(g)£«I2(g)Ę½ŗāĢåĻµ¼ÓŃ¹£¬ŃÕÉ«ŃøĖŁ±äÉī
C. ŗĻ³É°±¹¤Ņµ²ÉÓĆøßĪĀ”¢øßŃ¹¹¤ŅÕĢįøß°±µÄ²śĀŹ
D. ÅäÖĘĮņĖįŃĒĢśČÜŅŗŹ±£¬³£¼ÓČėÉŁĮæĢśŠ¼ŅŌ·ĄÖ¹Ńõ»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚Źō¼°ĘäĻą¹Ų»ÆŗĻĪļŌŚ»Æ¹¤”¢Ņ½Ņ©”¢²ÄĮĻµČĮģÓņӊ׏ć·ŗµÄÓ¦ÓĆ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĻĀĮŠ¹ŲÓŚ½šŹō¼°½šŹō¼üµÄĖµ·Ø²»ÕżČ·µÄŹĒ______”££ØĢī×ÖÄø“śŗÅ£©
a£®½šŹō¼üƻӊ·½ĻņŠŌÓė±„ŗĶŠŌ
b£®½šŹō¼üŹĒ½šŹōŌ×ÓÓė×ŌÓɵē×Ó¼äµÄĻą»„×÷ÓĆ
c£®½šŹōČŪ·Šµć²»Ķ¬µÄŌŅņæÉŅŌÓĆ½šŹō¼üĒæČõ½āŹĶ
d£®µē×ÓĘųĄķĀŪæɽāŹĶ½šŹō²ÄĮĻµÄŃÓÕ¹ŠŌ£¬²»ÄܽāŹĶ½šŹōÓŠĮ¼ŗƵĵ¼µēŠŌ
£Ø2£©·°¹ć·ŗÓĆÓŚ“߻Ƽ°øÖĢś¹¤Ņµ£¬»łĢ¬·°Ō×ӵļŪ²ćµē×ÓÅŲ¼Ķ¼ĪŖ_________________”£
£Ø3£©¶žĆÆĢśÓÖ½ŠĖ«»·Īģ¶žĻ©»łĢś[Fe(C5H5)2]£¬ČŪµćŹĒ172.5”«173 ”ę£¬100 ”ęŅŌÉĻÉż»Ŗ£¬¶žĆÆĢśŹōÓŚ_____¾§Ģ唣ŅŃÖŖ·Ö×ÓÖŠµÄ“󦊼üæÉÓĆ·ūŗÅ![]() ±ķŹ¾£¬ĘäÖŠm“ś±ķ²ĪÓėŠĪ³É“󦊼üµÄŌ×ÓŹż£¬n“ś±ķ²ĪÓėŠĪ³É“󦊼üµÄµē×ÓŹż£ØČē±½·Ö×ÓÖŠµÄ“󦊼üæɱķŹ¾ĪŖ
±ķŹ¾£¬ĘäÖŠm“ś±ķ²ĪÓėŠĪ³É“󦊼üµÄŌ×ÓŹż£¬n“ś±ķ²ĪÓėŠĪ³É“󦊼üµÄµē×ÓŹż£ØČē±½·Ö×ÓÖŠµÄ“󦊼üæɱķŹ¾ĪŖ![]() £©”£ŅŃÖŖ¶žĆÆĢśµÄĆæøöĆÆ»·“ųÓŠŅ»øöµ„Ī»øŗµēŗÉ£¬ŌņĆæøö»·ÖŠµÄ“󦊼üÓ¦±ķŹ¾ĪŖ________________”£
£©”£ŅŃÖŖ¶žĆÆĢśµÄĆæøöĆÆ»·“ųÓŠŅ»øöµ„Ī»øŗµēŗÉ£¬ŌņĆæøö»·ÖŠµÄ“󦊼üÓ¦±ķŹ¾ĪŖ________________”£
£Ø4£©ĶæÉŅŌŠĪ³ÉŅ»ÖÖĄė×Ó»ÆŗĻĪļ[Cu(NH3)4(H2O)2]SO4£¬ČōŅŖČ·¶Ø[Cu(NH3)4(H2O)2]SO4ŹĒ¾§Ģ廹ŹĒ·Ē¾§Ģ壬×īæĘѧµÄ·½·ØŹĒ¶ŌĘä½ųŠŠ______ŹµŃ飬ĘäÖŠŅõĄė×ÓµÄæռ乹ŠĶŹĒ_____£¬øĆ»ÆŗĻĪļ¼ÓČČŹ±Ź×ĻČŹ§Č„µÄ×é·ÖŹĒH2O£¬ŌŅņŹĒ_______________________”£
£Ø5£©×ī½ü·¢ĻÖ£¬Ö»ŗ¬Ć¾”¢ÄųŗĶĢ¼ČżÖÖŌŖĖŲµÄ¾§ĢåŅ²¾ßÓŠ³¬µ¼ŠŌ£¬øĆĪļÖŹŠĪ³ÉµÄ¾§ĢåµÄĮ¢·½¾§°ū½į¹¹ČēĶ¼ĖłŹ¾”£
¢ŁÓėMg½ōĮŚµÄNiÓŠ________øö”£
¢ŚŌ×Ó×ų±ź²ĪŹżæɱķŹ¾¾§°ūÄŚ²æø÷Ō×ÓµÄĻą¶ŌĪ»ÖĆ”£øĆ¾§°ūÖŠŌ×ÓµÄ×ų±ź²ĪŹżĪŖaĪŖ(0£¬0£¬0)£»bĪŖ(1/2£¬1/2£¬0)£»dĪŖ(1£¬1£¬1)”£ŌņcŌ×ÓµÄ×ų±ź²ĪŹżĪŖ_______”£
¢ŪČō¾§°ūÖŠNi”¢MgÖ®¼äµÄ×ī¶Ģ¾ąĄėĪŖa pm£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬Ōņ¾§ĢåµÄĆÜ¶Č¦Ń£½______g”¤cm£3(ÓĆŗ¬a”¢NAµÄ“śŹżŹ½±ķŹ¾)”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠĖȤŠ”×éµÄĶ¬Ń§½ųŠŠČż²ŻĖįŗĻĢśĖį¼Ų¾§ĢåK3[Fe(C2O4)3]”¤3H2O·Ö½āµÄŹµŃéĢ½¾æ”£¾Š”×éĢÖĀŪ£¬ĖūĆĒÉč¼ĘĮĖČēĻĀ×°ÖĆ½ųŠŠŹµŃ锣ÉÕĘæBÖŠŹ¢ÓŠ±„ŗĶNH4ClŗĶ±„ŗĶNaNO2»ģŗĻŅŗ(³£ÓĆÓŚŹµŃéŹŅÖĘN2)£¬øÉŌļ¹ÜC1֊װӊ¼īŹÆ»Ņ”£

(1)BÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______________________________________”£
(2)C2µÄ×÷ÓĆŹĒ_________________£¬C3ÖŠŹ¢×°µÄŹŌ¼ĮŹĒ___________________”£
(3)ČōŹµŃéÖŠ¹Ū²ģµ½E1”¢E4ÖŠµÄ³ĪĒåŹÆ»ŅĖ®¾ł±ä»ė×Ē£¬ŌņE3ÖŠµÄĻÖĻóŹĒ___________________£¬Ö¤Ć÷ĘųĢå²śĪļŹĒ___________________”£
(4)ŹµŃé×°ÖĆÖŠÓŠ2øö¾Ę¾«µĘ£¬ĻȵćČ¼A1£¬Ņ»¶ĪŹ±¼äŗó£¬ĻØĆšA1£¬¹Ų±Õ»īČūa£¬ŌŁµćČ¼A2£¬“żDÖŠµÄѳʷ³ä·Ö·“Ó¦ŗó£¬ŌŁ“Ī“ņæŖ»īČūa£¬µćČ¼A1£¬ŌņµŚ¶ž“ĪµćČ¼A1µÄĄķÓÉŹĒ________________________________________________________”£
(5)øĆŠ”×éĶ¬Ń§²éŌÄ׏ĮĻŗóĶĘÖŖ£¬ DÖŠ¹ĢĢå²śĪļÖŠ£¬ĢśŌŖĖŲ²»æÉÄÜŅŌČż¼ŪŠĪŹ½“ęŌŚ£¬¶ųŃĪÖ»ÓŠK2CO3”£ŹµŃé²āµĆC2”¢C3¹²ŌöÖŲ5.4g£»½«DÖŠ¹ĢĢåÉś³ÉĪļČÜÓŚĖ®£¬²āµĆ×īŗó²ŠÓą¹ĢĢåµÄÖŹĮæĪŖ6.88g”£Ķعż¼ĘĖć£¬¹ĢĢå²śĪļÖŠĢśŌŖĖŲµÄ“ęŌŚŠĪŹ½ĪŖ______£ØŠč±ķŹ¾³ö²śĪļµÄĪļÖŹµÄĮ棩”£
ČōŅŖĶعżŹµŃéŃŠ¾æÉĻŹö½įĀŪ£¬³ż3%H2O2”¢ÕōĮóĖ®Ķā£¬»¹ŠčŅŖĻĀĮŠŹŌ¼ĮÖŠµÄ___________”£
A£®1.0 mol”¤L£1HNO3 B£®1.0 mol”¤L£1ŃĪĖį C£®1.0 mol”¤L£1NaOHČÜŅŗ
D£®0.1 mol”¤L£1KIČÜŅŗ E£®0.1 mol”¤L£1CuSO4ČÜŅŗ F£®20%KSCNČÜŅŗ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾ŹĒ֊ѧ»Æѧ֊³£ÓĆÓŚ»ģŗĻĪļµÄ·ÖĄėŗĶĢį“æµÄ×°ÖĆ£¬Ēėøł¾Ż×°ÖĆ»Ų“šĻĀĮŠĪŹĢā£ŗ
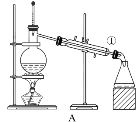
£Ø1£©“ÓĀČ»Æ¼ŲČÜŅŗÖŠµĆµ½ĀČ»Æ¼Ų¹ĢĢåŃ”Ōń×°ÖĆ___(Ģī“ś±ķ×°ÖĆĶ¼µÄ×ÖÄø£¬ĻĀĶ¬)£»³żČ„×ŌĄ“Ė®ÖŠµÄCl£µČŌÓÖŹŃ”Ōń×°ÖĆ____”£
£Ø2£©“ÓµāĖ®ÖŠ·ÖĄė³öI2£¬Ń”Ōń×°ÖĆ___£¬øĆ·ÖĄė·½·ØµÄĆū³ĘĪŖ____”£
£Ø3£©×°ÖĆAÖŠ¢ŁµÄĆū³ĘŹĒ____£¬½ųĖ®µÄ·½ĻņŹĒ____”£×°ÖĆBŌŚ·ÖŅŗŹ±ĪŖŹ¹ŅŗĢåĖ³ĄūµĪĻĀ£¬Ó¦½ųŠŠµÄ¾ßĢå²Ł×÷ŹĒ____”£
£Ø4£©ŗ£Ė®ÖŠŌĢ²Ų×Å·įø»µÄ׏Ō“£¬ŌŚŹµŃéŹŅ֊ȔɣĮæŗ£Ė®£¬½ųŠŠČēĶ¼Į÷³ĢµÄŹµŃé£ŗ
![]()
ĪŹĢā1£ŗ¾«ŃĪÖŠŗ¬Ca2£«”¢Mg2£«”¢SO42-µČŌÓÖŹ£¬ŠčŅŖĢį“æŗó²ÅÄÜ×ŪŗĻĄūÓĆ”£“ÖŃĪĢį“æµÄ²½ÖčÓŠ£ŗ¢Ł¼ÓČė¹żĮæµÄNa2CO3ČÜŅŗ£»¢Ś¼ÓČė¹żĮæµÄBaCl2ČÜŅŗ£»¢Ū¼ÓČė¹żĮæµÄNaOHČÜŅŗ£»¢Üµ÷½ŚČÜŅŗµÄpHµČÓŚ7£»¢ŻČܽā£»¢Ž¹żĀĖ£»¢ßÕō·¢”£ÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ____(Ģī×ÖÄø)”£
a£®¢Ż¢Ś¢Ū¢Ł¢Ž¢Ü¢ß b£®¢Ż¢Ł¢Ś¢Ū¢Ž¢Ü¢ß
c£®¢Ż¢Ś¢Ł¢Ū¢Ü¢Ž¢ß d£®¢Ż¢Ū¢Ś¢Ł¢Ž¢Ü¢ß
ĪŹĢā2£ŗ°“ĖłŃ”Ė³Šņ²Ł×÷Ź±£¬²½Öč¢ÜµÄ»Æѧ·½³ĢŹ½ŹĒ____”£
ĪŹĢā3£ŗÓÉŗ£Ė®µ½ĀČ»ÆÄĘ¾§ĢåµÄŹµŃé¹ż³ĢÖŠŅŖÓƵ½µÄÖ÷ŅŖ×°ÖĆŹĒ___(“Óøų¶ØµÄĖÄÖÖ×°ÖĆÖŠŃ”Ōń)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éĄūÓĆH2C2O4ČÜŅŗŗĶĖįŠŌKMnO4ČÜŅŗ·“Ó¦Ą“Ģ½¾æ”°Ķā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ”±”£ŹµŃ鏱£¬ĻČ·Ö±šĮæČ”Į½ÖÖČÜŅŗ£¬Č»ŗóµ¹ČėŹŌ¹ÜÖŠŃøĖŁÕńµ“»ģŗĻ¾łŌČ£¬æŖŹ¼¼ĘŹ±£¬Ķعż²ā¶ØĶŹÉ«ĖłŠčŹ±¼äĄ“ÅŠ¶Ļ·“Ó¦µÄæģĀż”£øĆŠ”×éÉč¼ĘĮĖČēĻĀ·½°ø”£
ŹµŃ鱹ŗÅ | ŹŅĪĀĻĀ£¬ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ/mL | ŹŅĪĀĻĀČÜŅŗŃÕÉ«ĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä/min | |||
0.6mol/L H2C2O4ČÜŅŗ | H2O | 0.2mol/LKMnO4ČÜŅŗ | 3mol/L Ļ”ĮņĖį | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |
(1)øł¾ŻÉĻ±ķÖŠµÄŹµŃ鏿¾Ż£¬æÉŅŌµĆµ½µÄ½įĀŪŹĒ______________________________”£
(2)øĆŠ”×éĶ¬Ń§øł¾Ż¾Ńé»ęÖĘĮĖn(Mn2+)Ėꏱ¼ä±ä»ÆĒ÷ŹĘµÄŹ¾ŅāĶ¼£¬ČēĶ¼1ĖłŹ¾”£µ«ÓŠĶ¬Ń§²éŌÄŅŃÓŠµÄŹµŃé׏ĮĻ·¢ĻÖ£¬øĆŹµŃé¹ż³ĢÖŠn(Mn2+)Ėꏱ¼ä±ä»ÆµÄĒ÷ŹĘÓ¦ČēĶ¼2ĖłŹ¾”£øĆŠ”×éĶ¬Ń§øł¾ŻĶ¼2ĖłŹ¾ŠÅĻ¢Ģį³öĮĖŠĀµÄ¼ŁÉč£¬²¢¼ĢŠų½ųŠŠŹµŃéĢ½¾æ”£

øĆŠ”×éĶ¬Ń§Ģį³öµÄ¼ŁÉčŹĒ___________________________________”£
¢ŚĒėÄć°ļÖśøĆŠ”×éĶ¬Ń§Ķź³ÉŹµŃé·½°ø£¬²¢ĢīŠ“±ķÖŠæÕ°×”£
ŹµŃ鱹ŗÅ | ŹŅĪĀĻĀ£¬ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ/mL | ŌŁĻņŹŌ¹ÜÖŠ¼ÓČėÉŁĮæ¹ĢĢåX | ŹŅĪĀĻĀČÜŅŗŃÕÉ«ĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä/min | |||
0.6mol/L H2C2O4ČÜŅŗ | H2O | 0.2mol/LKMnO4ČÜŅŗ | 3mol/L Ļ”ĮņĖį | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
¹ĢĢåXŹĒ__________”£
¢ŪČōøĆŠ”×éĶ¬Ń§Ģį³öµÄ¼ŁÉč³ÉĮ¢£¬Ź±¼ät__________4.0min£ØĢī>”¢=»ņ<£©”£
(3)ĪŖĢ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬øĆŠ”×éĶ¬Ń§×¼±øŌŚÉĻŹöŹµŃ黳“”ÉĻ¼ĢŠų½ųŠŠŹµŃ飬ĒėÄć°ļÖśøĆŠ”×éĶ¬Ń§Ķź³ÉøĆŹµŃé·½°øÉč¼Ę____________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŅŅĻ©µÄĆčŹö²»ÕżČ·µÄŹĒ£Ø £©
A.ÄÜŹ¹äåĖ®ĶŹÉ«B.Äܹ»Č¼ÉÕ£¬Ķ¬Ź±²śÉśŗŚŃĢ
C.ÄÜÓėĖįŠŌøßĆĢĖį¼Ų·¢Éś¼Ó³É·“Ó¦D.ÄÜÓĆĄ“ÖĘ×÷øß·Ö×Ó²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)ijӊ»śĪļÓÉC”¢H”¢OČżÖÖŌŖĖŲ×é³É£¬Ēņ¹÷Ä£ŠĶČēĶ¼ĖłŹ¾£ŗ
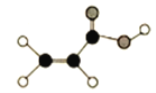
¢Łŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒ_______£»
¢ŚŠ“³ö“ĖÓŠ»śĪļÓė½šŹōÄĘ·“Ó¦µÄ»Æѧ·½³ĢŹ½_______”£
(2)ĖÄÖÖ³£¼ūÓŠ»śĪļ·Ö×ӵıȥżÄ£ŠĶŹ¾ŅāĶ¼ČēĻĀ£¬ĘäÖŠ¼×”¢ŅŅ”¢±ūĪŖĢž£¬¶”ĪŖĢžµÄŃÜÉśĪļ”£

¢ŁæÉŅŌ¼ų±š¼×ŗĶŅŅµÄŹŌ¼ĮĪŖ_________£»
a.Ļ”ĮņĖį b.äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ c.Ė® d.ĖįŠŌøßĆĢĖį¼ŲČÜŅŗ
¢ŚÉĻŹöĪļÖŹÖŠÓŠ¶¾”¢ÓŠĢŲŹāĘųĪ¶£¬ĒŅ²»ČÜÓŚĖ®”¢ĆܶȱČĖ®Š”µÄŹĒ_________£ØĢīĆū³Ę£©£¬
¢ŪŅŅŗĶ¶”µÄĪļÖŹµÄĮæ¹²1.5mol£¬ĶźČ«Č¼ÉÕŠčŅŖµÄŃõĘųµÄĪļÖŹµÄĮæŹĒ_______”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com