
| A. | 加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入硝酸银溶液,生成白色沉淀,加稀盐酸沉淀不消失,一定有Cl- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 滴加BaCl2溶液,生成白色沉淀,再加入稀硝酸沉淀不溶,一定有SO42- |
分析 A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,二氧化碳气体遇澄清石灰水变浑浊;
B、含有氯离子、亚硫酸根离子的溶液加入硝酸银溶液,生成白色沉淀,加稀盐酸沉淀不消失.
C、铵盐和碱之间反应可以得到氨气碱性气体,湿润红色石蕊试纸遇碱性物质变蓝;
D、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀.
解答 解:A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,加入稀盐酸产生无色气体,不一定有CO32-,故A错误;
B、加入硝酸银溶液,生成白色沉淀,加稀盐酸沉淀不消失,则溶液含有氯离子或是亚硫酸根离子中的至少一种,故B错误;
C、湿润红色石蕊试纸遇碱性物质变蓝,加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+,故C正确;
D、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-,故D错误.
故选C.
点评 本题考查了常见离子的检验,完成此题,可以依据已有的知识进行解答.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
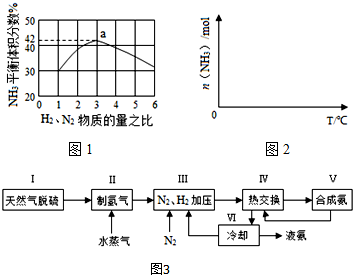
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+Mg2+CH3COO-SO42- | |
| B. | PH=13的溶液中:Ba2+K+Cl-HCO3- | |
| C. | 无色溶液中:K+Fe3+CO32-NO3- | |
| D. | 透明溶液中:Na+NH4+NO3-MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
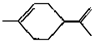 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 它不能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为液态,易溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为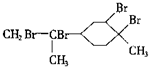 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②一样多 | B. | ②比①多 | C. | ①比②多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
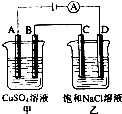 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )| A. | 甲烧杯中B极上最多可析出铜0.64g | |
| B. | 甲烧杯中A极上电极反应式4OH--4 e-═2H2O+O2↑ | |
| C. | 烧杯中D极上电极反应式为4H++4 e-═2H2↑ | |
| D. | 乙烧杯中滴入酚酞试液,C极附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2气体通入石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O | |
| B. | 钠被氧气氧化:4Na+O2═2Na2O | |
| C. | CO气体通过灼热的CuO:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | |
| D. | NH3通入硝酸溶液中:NH3+HNO3═NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
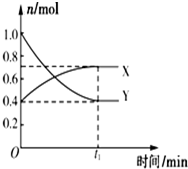 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com