
| A、实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗 |
| B、用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
| C、重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 |
| D、用丁达尔现象可鉴别蛋白质溶液、淀粉溶液和葡萄糖溶液 |


科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
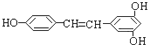
 我国在反兴奋剂问题上的立场是坚决支持“人文奥运”的.某种兴奋剂的结构如图所示.关于它的叙述正确的是( )
我国在反兴奋剂问题上的立场是坚决支持“人文奥运”的.某种兴奋剂的结构如图所示.关于它的叙述正确的是( )| A、它的分子式为C20H22O3 |
| B、它易溶于水 |
| C、它的分子中共平面的碳原子最多有16个 |
| D、1mol它最多可与7molH2和含4mol Br2的溴水发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
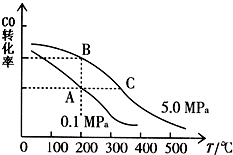 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
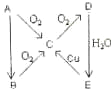 A、B、C、D、E、在一定条件下的转换条件如图所示:
A、B、C、D、E、在一定条件下的转换条件如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com