
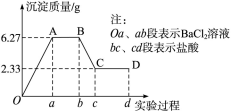


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.①③ | C.②③ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
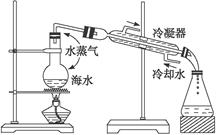
| A.本装置缺少温度计,所以无法进行海水蒸馏 |
| B.海水经过本装置的蒸镏后,锥形瓶中得到的是淡水 |
| C.装置中冷凝器中水流的方向不对,应该为上口进水,下口出水,便于水流下 |
| D.海水蒸馏前须加入沸石以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.②①③⑤④ |
| B.②③①⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl-存在 |
| B.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在 |
| C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在 |
| D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量CO32-存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.被测样品中含有加热不挥发的杂质 | B.被测样品中含有加热易挥发的杂质 |
| C.实验前被测样品已有部分失水 | D.加热前所用的坩埚未完全干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com