
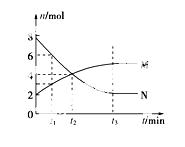
 在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
A.反应的化学方程式为2M N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
科目:高中化学 来源: 题型:
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 ▲
(2) SO42-的空间构型是 ▲ (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 ▲ (不定项选择)。
a. N2O结构式可表示为N=N=O
b. O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH30CH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为 ▲ 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为
 ▲ (填数字).
▲ (填数字).
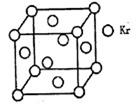
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= ▲ (填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素的原子半径:rZ>rX>rY>rW
B.X、Y、Z、W形成的单质最多有6种
C.四种元素均可与氢元素形成18电子分子
D.四种元素中,Z的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4 ·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。
·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。
实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是_______________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+, 离子方程式如下:
离子方程式如下:
Cr2O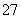 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________________________________和__________________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________ mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填选项字母)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2SO2(g)+O2(g)  2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内消耗n mol SO2的同时生成n mol SO2
②单位时间内消耗2n mol SO2的同时生成n mol O2
③用SO2、O2、SO3的物质的量浓度变化表示的反应速率的比为2∶1∶2的状态
④混合气体的密度不再改变的状态
A.①② B.①②④
C.①②③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
处于平衡状态的反应2 H2 S(g)  2H2(g)+S2(g)
2H2(g)+S2(g)  H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变, H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当
温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:__________________。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1=__________________。
②根据上述信息判断,T1和T2的关系是__________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组针对如何测定镀锌铁皮镀锌层厚度提出如下一些方案:
方案1.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,通过测量氢气的体积,计算铁皮上的锌的质量。
方案2.将一定质量的镀锌铁皮(W1)投入到足量的FeSO4溶液中,一段时间后,取出铁片,洗净、烘干、称量(W2),计算铁皮上的锌的质量。
方案3.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,过滤、洗涤、烘干、灼烧、沉淀,最后称量。
……
(1)方案2的主要特点是__________,
方案3的主要缺点是__________。
(2)方案1中用到测量气体体积的装置,如图装置中不能用于测量气体体积的装置是 。
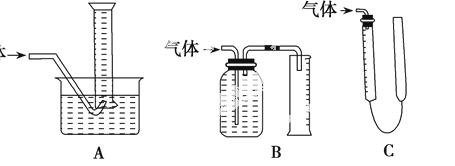
学习小组拟选用C装置作量气装置,则气体收集完毕,准备读数时,应注意:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com