
【题目】HCHO与O2在羟基磷灰石(HAP)表面反应通过两步反应生成CO2、H2O的机理如图所示(图中只给出了HAP的部分结构)。下列说法错误的是( )
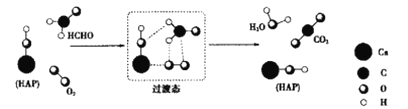
A.HCHO在反应过程中,所有C-H键都发生断裂
B.反应第一步是吸热过程
C.产物H2O中的O全部来自于O2
D.HAP是该反应的催化剂
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为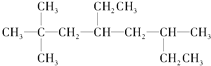 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 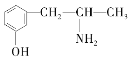 B.
B. ![]() C.
C. 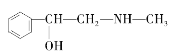 D.
D. 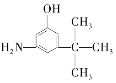 E.
E. 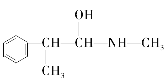
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
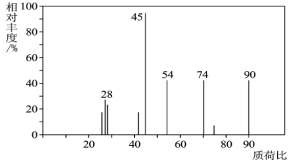
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
A. B.
B.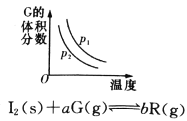
C. D.
D.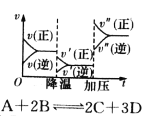
A.t0时改变某一条件有如图所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应
C.从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应
D.反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B、C是气体、D为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述及化学用语的表示方法正确的是( )
A.原子核内有8个中子的基态碳原子价电子排布图为:![]()
B.NH4F的电子式为:![]() ,三种元素中氟的第一电离能最大
,三种元素中氟的第一电离能最大
C.铜属于d区元素,溴属于p区元素,二者基态原子未成对电子数目相同
D.CO2分子的结构式为:O=C=O,碳的原子半径大于氧的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:焦性没食子酸的碱性溶液可吸收O2。碘化亚铁(FeI2)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性。实验室用如图装置制备FeI2。下列说法错误的是( )
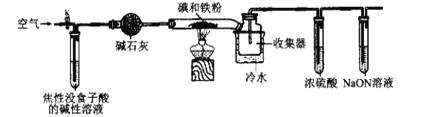
A.空气的主要作用是将产生的FeI2吹入收集器中
B.冷水的作用是将升华的FeI2凝华便于收集,使用粗玻璃管可以防止堵塞
C.浓硫酸的作用是防止水蒸气进入收集器而引起FeI2潮解
D.向FeI2溶液中通入等物质的量的Cl2,反应的离子方程式为:2Fe2++2Cl2=2Fe3++4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,也可作燃料。工业上可用CO2和H2在一定条件下合成甲醇。回答下列问题。
(1)已知:CO 和 H2 的燃烧热分别为 283.0 kJ·mol-1、285.8kJ·mol-1 ,水的汽化热为 44.0kJ·mol-1, 反应① CO+H2O=CO2+H2 是生成合成甲醇的原料气(CO2、H2)的重要反应,其热化学方程式为: CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =_____ kJ·mol-1。
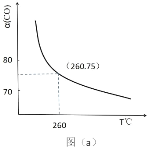
(2)某同学设计实验对反应①进行研究。将 1mol H2O(g)和 1mol CO 充入一个恒容密闭容器中,在催化剂和一定温度下达到化学平衡。如图是 CO 的平衡转化率(%)随温度变化的曲线,260℃时反应①的平衡常数 K=_______。
(3)CO2和 H2在催化剂、一定温度下合成甲醇。图为在容积为 1L 的恒容密闭容器中,加入 3 molH2和 1molCO2时经过相同时间甲醇产率与反应温度的关系曲线:
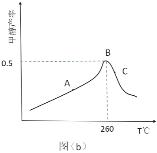
曲线上 A 点_____(填“是”或“不是”)对应温度下的平衡产率,理由是_____,C 点甲醇的产率低于 B 点的原因可能是_____(填标号)。
A.反应活化能增大 B.催化剂活性低 C.副反应多 D.平衡常数变大 E.平衡逆向移动
(4)CO和 H2在一定条件下也可以合成甲醇。在容积为1L的恒容密闭容器中,加入 a molH2和2.0molCO,在催化剂和 260℃温度条件下发生反应:CO+2H2=CH3OH。图为甲醇的浓度与反应时间的关系曲线,tP 时的 v 逆_____tQ 时的 v 逆(填大于、小于或等于),判断的依据是_____,达平衡时氢气的浓度为 1.0mol/L,则起始时加入的氢气的物质的量为_____mol。
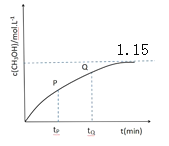
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)可用作纺织行业的印染剂。为充分利用资源,探究废旧干电池的变废为宝,在实验室中用废旧干电池中的MnO2制备Mn2O3,流程如图:
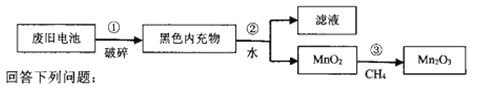
(l)步骤②加水后的操作,需要的玻璃仪器除烧杯外还需__(填标号)。
A.玻璃棒 B.分液漏斗 C.普通漏斗 D.酒精灯
(2)步骤③用图中的甲装置所产生的CH4,还原MnO2制备Mn2O3。
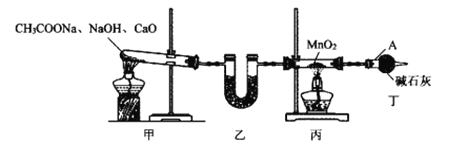
①仪器A的名称为__,装置乙内盛有的试剂可以是__(填标号)。
a.浓硫酸 b.碱石灰 c.胆矾 d.五氧化二磷
②实验过程中先点燃__(填“甲”或“丙”)处的酒精灯,点燃丙处酒精灯前需进行的操作是___。
③测定装置丙内生成物中CO、CO2物质的量为1:1,则该反应的化学方程式为__。
④该装置存在的缺陷为__。
(3)实验结束,仪器冷却后,称取装置丙内粗产品为7.19g,使之与足量硫酸酸化的KI溶液反应(粗产品中的Mn2O3和MnO2的锰元素均转化为Mn2+),将该混合液稀释至500mL,然后取25.00mL稀释后的溶液,用0.200molL-1的Na2S2O3;标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液为25.00mL。(已知:I2+2Na2S2O3═Na2S4O6+2NaI)
①该滴定过程中可以选用__作指示剂。
②若滴定前滴定管内无气泡,达到滴定终点时,尖嘴处有气泡,则测定的标准液的体积__(填“偏大”、“偏小”或“无影响”)。
③粗产品中Mn2O3的纯度为__%。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.0100 mol/L的NaOH溶液滴定10. 00 mL 0.0100 mol/L的二元酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中的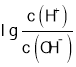 关系如图所示,下列说法正确的是( )
关系如图所示,下列说法正确的是( )

A.H2A的电离方程式为:H2A=A2-+2H+
B.B点显酸性的原因是HA的电离程度大于其水解程度
C.C点溶液显中性,所以 c(Na+)=c(A2-) +c(HA-)
D.常温下Kh(Na2 A)的数量级约为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com