
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
分析 A、过氧化钠由2个钠离子和1个阴离子构成;
B、氧气所处的状态不明确;
C、氧气和臭氧均由氧原子构成;
D、溶液体积不明确.
解答 解:A、过氧化钠由2个钠离子和1个阴离子构成,故1mol过氧化钠中含NA个阴离子,故A错误;
B、氧气所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故B错误;
C、氧气和臭氧均由氧原子构成,故8g混合物中含有的氧原子的物质的量为n=$\frac{8g}{16g/mol}$=0.5mol,而氧原子中含8个电子,故0.5mol氧原子中含4NA个电子,故C正确;
D、溶液体积不明确,故溶液中的氢离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
.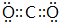 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为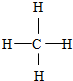 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
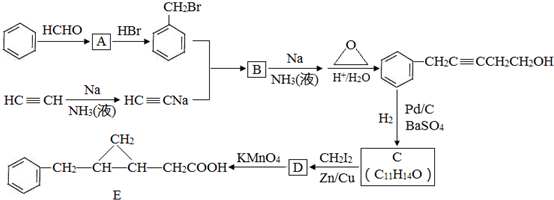
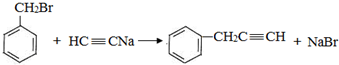 ,反应类型是取代反应.
,反应类型是取代反应.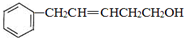 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.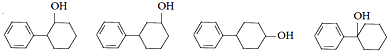 任意2种.
任意2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
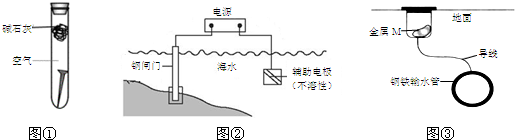
| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)=0.1 mol•L-1 | |
| B. | 0.2 mol•L-1NaHS溶液和0.1 mol•L-1Na2S溶液等体积混合,混合液中:3c(Na+)=4c(H2S)+4c(HS-)+4c(S2-) | |
| C. | KAl(SO4)2的水溶液中:c(SO42-)>c(A13+)>c(K+)>c(H+)>c(OH-) | |
| D. | H2SO3溶液中:c(H+)=2c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
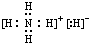 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
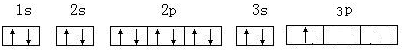
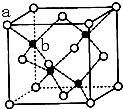 A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb
A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 中和滴定时,锥形瓶先用蒸馏水润洗,再用待测液润洗 | |
| B. | 检验某溶液中含有Na+无K+时,用洁净的铂丝蘸取该溶液,灼烧,观察火焰颜色 | |
| C. | 用图1所示装置,将Cl2和HCl的混合气体通过饱和NHCO3溶液,除去Cl2中HCl | |
| D. | 用图2所示装置,向含有少量水的乙醇中加入足量生石灰,蒸馏,得到无水乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com