
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
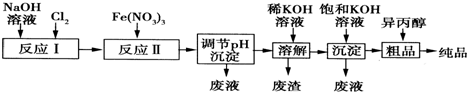
分析 反应Ⅰ为:2NaOH+Cl2═NaCl+NaClO+H2O,由湿法制备信息,可知反应Ⅱ:3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O,调节溶液pH,使溶液Fe3+、FeO42-转化为沉淀,加入KOH溶液溶解,过滤除去氢氧化铁,再加入饱和KOH溶液可以增大K+浓度,促进K2FeO4晶体析出.
(1)①反应I是氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
②由湿法制备信息,可知碱性条件下,ClO-与Fe3+反应得到FeO42-,ClO-被还原为Cl-,配平书写离子方程式;
③根据氢氧化铁的溶度积计算c(OH-),再根据水的离子积计算c(H+),进而计算溶液pH值;
(2)①氧化剂的氧化性强于氧化产物氧化性;
②湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,说明高铁酸钾溶解度小;
(3)高铁酸钾具有很强的氧化性,能杀菌消毒,还原生成的铁离子在水中生成的Fe(OH)3胶体具有吸附性;
(4)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,根据电子转移守恒计算二者物质的量之比.
解答 解:反应Ⅰ为:2NaOH+Cl2═NaCl+NaClO+H2O,由湿法制备信息,可知反应Ⅱ:3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O,调节溶液pH,使溶液Fe3+、FeO42-转化为沉淀,加入KOH溶液溶解,过滤除去氢氧化铁,再加入饱和KOH溶液可以增大K+浓度,促进K2FeO4晶体析出.
(1)①反应I是氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O;
②由湿法制备信息,可知碱性条件下,ClO-与Fe3+反应得到FeO42-,ClO-被还原为Cl-,离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol/L,Ksp=c(Fe3+)×c3(OH-),c3(OH-)=$\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-5}}$=10-33,则c(OH-)=10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,则铁离子沉淀的溶液pH=-lg10-3=3,
故答案为:3;
(2)①高铁酸钠和水反应生成Fe(OH)3和O2生成,高铁酸钠为氧化剂、O2 为氧化产物,则高铁酸钠的氧化性比O2 强,故答案为:强;
②湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,利用溶解度不同,说明高铁酸钾的溶解度比高铁酸钠的小,
故答案为:小;
(3)高铁酸钾具有很强的氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体,有吸附性,可以吸附水中的吸附物质,
故答案为:高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用;
(4)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
反应N元素化合价由+5价降低为+3价,KNO3是氧化剂,铁的化合价由+3价升高为+6价,Fe2O3是还原剂,根据电子转移守恒:n(KNO3)×(5-3)=2×n(Fe2O3)×(6-3),故n(KNO3):n(Fe2O3)=3:1,
故答案为:3﹕1.
点评 本题考查实验制备方案,涉及方程式书写、溶度积有关计算、平衡移动原理、水的净化、氧化还原反应计算等,明确工艺流程原理是解题关键,注意对题目给予的信息的运用,较好的考查学生综合能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如下图),下列有关说法正确的是( )
正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如下图),下列有关说法正确的是( )| A. | 正硼酸晶体属于原子晶体 | |
| B. | H3BO3分子的稳定性与氢键有关 | |
| C. | 分子中硼原子最外层满足8电子稳定结构 | |
| D. | 1 mol H3BO3晶体中有3 mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
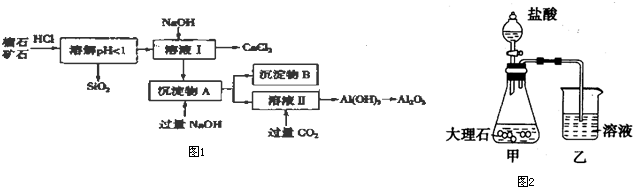
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.
甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

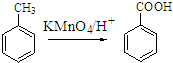
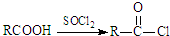
 ;原料B发生反应④所需的条件为浓硫酸、加热.
;原料B发生反应④所需的条件为浓硫酸、加热. ;⑤
;⑤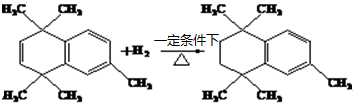 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com