
| A. | 能使溴的四氯化碳溶液褪色 | B. | 是天然气的主要成分 | ||
| C. | 不能发生燃烧反应 | D. | 能发生加成反应 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

 .
. +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$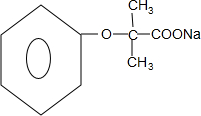 +3NaCl+2H2O.
+3NaCl+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
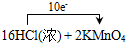 ═2KCl+2MnCl2+5Cl2↑+8H2O
═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是吸热反应 | |
| B. | 反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 由方程式可知,CH4的燃烧热为802.3 kJ•mol-1 | |
| D. | 该式的含义为:25℃、101 kPa下,1molCH4气体完全燃烧生成CO2和液态水时放出热量802.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOK的相对分子质量为98 mol-1 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 mol CH3COOK含有3×6.02×1023个H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③⑤ | C. | ①②④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com