

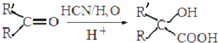
 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. .
. .
.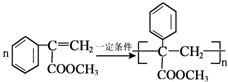 .
.分析 苯与氯气发生取代反应生成氯苯,氯苯反应得到I,I与C反应得到N,结合N的结构可知,A为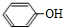 ,C为
,C为 ,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成
,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成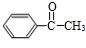 ,由反应信息可知B为
,由反应信息可知B为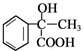 ,B与甲醇发生酯化反应生成D为
,B与甲醇发生酯化反应生成D为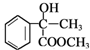 ,D发生消去反应生成E为
,D发生消去反应生成E为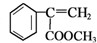 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 ,据此解答.
,据此解答.
解答 解:苯与氯气发生取代反应生成氯苯,氯苯反应得到I,I与C反应得到N,结合N的结构可知,A为 ,C为
,C为 ,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成
,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成 ,由反应信息可知B为
,由反应信息可知B为 ,B与甲醇发生酯化反应生成D为
,B与甲醇发生酯化反应生成D为 ,D发生消去反应生成E为
,D发生消去反应生成E为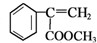 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 .
.
(1)B为 ,含氧官能团的名称是:羧基、羟基,故答案为:羧基、羟基;
,含氧官能团的名称是:羧基、羟基,故答案为:羧基、羟基;
(2)由 生成
生成 的反应类型是:取代反应,故答案为:取代反应;
的反应类型是:取代反应,故答案为:取代反应;
(3)反应Ⅰ是 转化为
转化为 ,反应条件是:氢氧化钠水溶液加热后酸化,故答案为:氢氧化钠水溶液加热后酸化;
,反应条件是:氢氧化钠水溶液加热后酸化,故答案为:氢氧化钠水溶液加热后酸化;
(4)化合物C的结构简式是: ,故答案为:
,故答案为: ;
;
(5)反应Ⅱ的化学方程式是: ,
,
故答案为: ;
;
(6)a.A为 ,含有酚羟基,可与NaOH溶液反应,故a正确;
,含有酚羟基,可与NaOH溶液反应,故a正确;
b. 在常温下微溶于水,高于65℃时,能和水混溶,故b错误;
在常温下微溶于水,高于65℃时,能和水混溶,故b错误;
c.化合物C为 ,含有醛基、碳碳双键,可使高锰酸钾酸性溶液褪色,故c正确;
,含有醛基、碳碳双键,可使高锰酸钾酸性溶液褪色,故c正确;
d.E为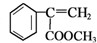 ,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故d错误,
,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故d错误,
故选:cd;
(7)反应Ⅲ的化学方程式是: ,
,
故答案为: ;
;
(8)符合下列条件的B( )的同分异构体:
)的同分异构体:
a.能与饱和溴水反应生成白色沉淀,说明含有酚羟基,且至少酚羟基对位或邻位有H原子,b.属于酯类 c.苯环上只有两个对位取代基,另外的取代基为:-OOCCH2CH3、或-CH2OOCCH3、或-COOCH2CH3、或-CH2CH2OOCH、或-CH(CH3)OOCH、或-CH2COOCH3,共有6种,
故答案为:6.
点评 本题考查有机物的推断,结合有机物的结构、反应条件下进行推断,需要学生对给予的信息进行利用,较好的考查学生的自学能力、分析推理能力,需要学生熟练掌握官能团的性质与转化,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为:C10H9O5Br | |
| B. | 该有机物能发生银镜反应 | |
| C. | 1mol该有机物能与含3mol Br2的溴水发生加成反应 | |
| D. | 该有机物与热的NaOH溶液反应后有HOCH2COONa生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
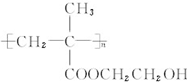
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
 .
.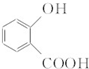 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com