
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
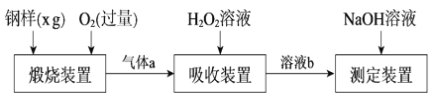
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
【答案】SO2 O2 Fe3O4 SO2 H2O2+SO2=== H2SO4 (yz)/x×100%
【解析】
(1)该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
(2)由质量守恒定律可知,3molFeS反应生成1 Fe3O4 mol 和3mol SO2;
(3)双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水;
(4)若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数。
(1)煅烧时,钢铁中所含的C元素和S元素与氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2,故答案为:SO2;O2;
(2)由题意可知,FeS与O2高温条件下反应应该生成铁的氧化物和二氧化硫,由质量守恒定律可知,3molFeS反应生成1 Fe3O4 mol 和3mol SO2,反应方程式为3FeS+5O2 ![]() Fe3O4+3SO2,故答案为:Fe3O4;SO2;
Fe3O4+3SO2,故答案为:Fe3O4;SO2;
(3)双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为 H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4;
(4)若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,硫的质量分数为yzg/xg=yz/x,故答案为:(yz)/x×100%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,不能生成NaOH的是 ( )
A.Na和H2O B.Ca(OH)2溶液和NaCl溶液
C.Ca(OH)2溶液和Na2CO 3溶液 D.Na2O 2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
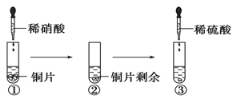
①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol/L的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000molL的KCl、KBr及KI溶液,其滴定曲线入下图,(已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17),下列说法正确的是

A. V0= 45.00
B. 滴定曲线①表示KCl的滴定曲线
C. 滴定KCl时,可加入少量的KI作指示剂
D. 当AgNO3溶液滴定至60.00mL 时,溶液中 c(I-)-)-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-Fe2O3是一种具有磁性、催化等作用的纳米材料,以硫铁矿烧渣等为原料生产制备-Fe2O3的流程如下:
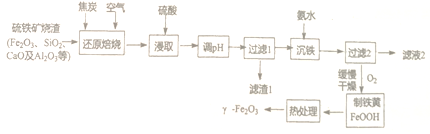
已知:“还原焙烧”的主要反应为:3C+2O2![]() 3CO↑+CO2↑,Fe2O3+CO
3CO↑+CO2↑,Fe2O3+CO![]() 2FeO + CO2
2FeO + CO2
回答下列问题:
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是_____________________。
(2)“滤渣1”除了CaSO4外还有_______________。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(Al3+)=____________。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是______________;
(5)沉淀缓慢氧化为铁黄的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、Al2(SO4)3的混合済液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如右图所示,则原溶液中SO42—与Cl—的物质的量之比是( )
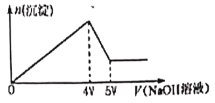
A. 1:2 B. 1:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
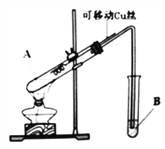
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com