

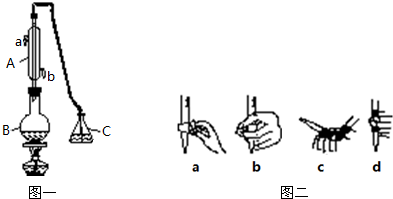
分析 (1)氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;
根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(2)由于蒸馏时盐酸易挥发,消耗盐酸增多,该测定结果比实际值高;
Ⅰ、依据溶度积常数计算离子浓度;
Ⅱ、改用0.01000mol•L-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点;
空气氧化作用消耗标准溶液体积减小,测定结果偏低.
解答 解:(1)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用c的方法;
根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,
故答案为:c;0.32;
(2)由于蒸馏时盐酸易挥发,测定过程中消耗盐酸量增多,所以该测定结果比实际值高;
故答案为:偏高;
Ⅰ、当观察到出现淡红色沉淀且不再消失时停止滴定,若此时Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol•L-1,c(Ag+)=$\frac{Ksp}{c(Cl{\;}^{-})}$=$\frac{2×10{\;}^{-10}}{1.0×10{\;}^{-5}}$=2.0×10-5mol/L,则此时溶液中的c(CrO42-)=$\frac{Ksp}{c{\;}^{2}(Ag{\;}^{+})}$=$\frac{1.12×10{\;}^{-12}}{(2.0×10{\;}^{-5}){\;}^{2}}$=2.8×10-3mol•L-1;
故答案为:2.8×10-3;
Ⅱ、改用0.01000mol•L-1标准I2溶液滴定,可选择淀粉溶液做指示剂,滴定终点的现象是:滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点;
故答案为:淀粉溶液;最后一滴标准溶液滴入溶液变蓝色且半分钟不变化.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 10Q | B. | 5Q~10Q | C. | 3Q | D. | 8Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人的人体内体液pH总保持恒定 | |
| C. | 食物的酸碱性与化学上所指溶液的酸碱性不同的 | |
| D. | 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
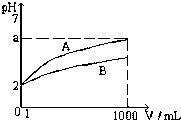 T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示
T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.2NA | |
| B. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 在0℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因亚硝酸钠有剧毒,所以不能用作食品添加剂 | |
| B. | 可用淀粉-KI试纸来鉴别一种盐溶液是亚硝酸钠还是氯化钠 | |
| C. | 能用硝酸银溶液来区别亚硝酸钠与氯化钠 | |
| D. | 因NaNO2具有较强的氧化性,可用酸性KMnO4溶液和FeCl2溶液鉴别NaCl与NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com