
【题目】常温下,向20.00mL 0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
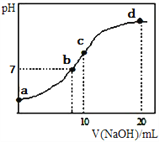
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
【答案】C
【解析】A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42-),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3H2O)=2c(SO42-)=2c(Na+),所以得c(SO42-)+c(H+)=c(NH3H2O)+c(OH-),故C正确;D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3H2O)>c(SO42-),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物( )
A.不能透过滤纸 B.一定是浊液
C.一定是溶液 D.有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
a、b、c、d、e、f是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:图1表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
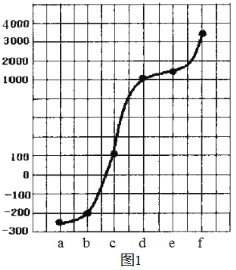
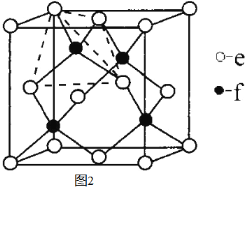
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为 (用元素符号表示)。
(2)元素b的单质的一个分子中含有 个σ键和 个π键。
(3)元素c的单质的晶体堆积方式类型是 ;若c单质分别与氟气和氯气形成化合物甲和乙,则甲的晶格能 乙的晶格能(填“>”、“<”或“=”)。
(4)元素d的单质基态原子的价电子排布式为 (用NA表示阿伏加德罗常数的值)。
(5)元素e和f可形成化合物丙(丙的晶胞结构如图2所示),则丙的化学式为 ;丙的晶体类型为 ,在丙中,每个e原子周围最近的e原子数目为 ,若晶胞的边长为a pm,则丙的密度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.78 g Na2O2与足量CO2充分反应时电子转移数为NA
B.2.24L O2的分子数约为0.1NA
C.在标准状况下,2.24L H2O含有的分子数0.1NA
D.0.1mol/L NaOH溶液中所含的Na+为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接由原子构成的一组物质是 ( )
A. 干冰、二氧化硅、金刚石
B. 氧化钠、金刚石、氯化氢
C. 碘、石墨、氯化钠
D. 二氧化硅、金刚石、晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ka=1.77×104 | Ka=4.9×1010 | Ka1=4.3×107 Ka2=5.6×1011 |
下列选项正确的是
A.NaCN溶液中通入少量CO2气体:c(Na+) > c(![]() ) >c(
) >c(![]() )
)
B.稀释等体积、等浓度的HCOOH和HCN至相同pH,加水的体积前者小于后者
C.物质的量浓度相等的HCOONa和KCN溶液中:c(Na+)c(HCOO) >c(K+)c(CN)
D.等体积、等浓度的HCOOH和NaCN混合溶液中:c(H+)+c(HCN) =c(HCOO)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。
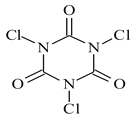
(1)利用尿素CO(NH2)2加热可以合成三氯异氰尿酸,同时产生氨气。生成1mol三氯异氰尿酸同时生成氨气的体积为 (标准状况下)。
(2)“有效氯”含量是指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.2840 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1000 mol·L1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点。重复测定2次,所得的相关数据如下表:
滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
1 | 25.00 | 0.00 | 23.98 |
2 | 25.00 | 0.08 | 24.08 |
3 | 25.00 | 0.16 | 24.18 |
①滴定中Na2S2O3被氧化为Na2S4O6,该反应的化学方程式为 。
②配制0.1000 mol·L1 Na2S2O3溶液100 mL,所需Na2S2O3·5H2O的质量为 。
③计算此样品的“有效氯”含量(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【实验化学】
对叔丁基苯酚![]() 可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
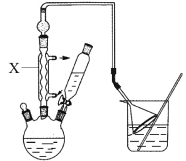
步骤1:按图组装仪器,在三颈烧瓶中加入2.2 mL叔丁基氯(过量)和1.41 g苯酚,搅拌使苯酚完全溶解。
步骤2:向三颈烧瓶中加入无水AlCl3固体作催化剂,不断搅拌,有气体放出。
步骤3:反应缓和后,向三颈烧瓶中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应放热反应,其化学方程式为 。
该反应温度不宜过高(60℃),其原因是 ,可采取的措施为 。
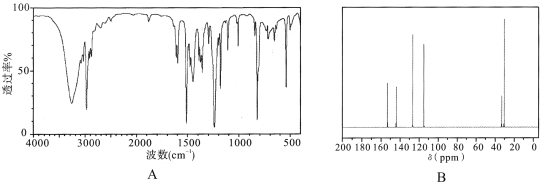
(3)实验结束后,对产品进行光谱鉴定结果如下。其中属于红外光谱的谱图是 (填字母)。
(4)本实验中,对叔丁基苯酚的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com