
分析 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可.
解答 解:反应Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe为一种单质与一种化合物生成另外一种单质与另一种化合物的反应,属于置换反应类型,反应中Al元素的化合价升高,则Al为还原剂,被氧化,发生氧化反应,生成Al2O3为氧化产物;而Fe元素的化合价降低,则Fe2O3为氧化剂,被还原,发生还原反应,
故答案为:置换反应;还原;Fe2O3;Al2O3.
点评 本题主要考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和反应类型的考查,题目难度不大


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:实验题
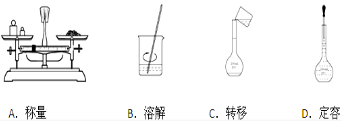
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
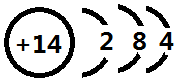 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | 丙烷分子的比例模型: | ||
| C. | 1,3-丁二烯的分子式:C4H8 | D. | 甲酸甲酯的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
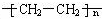 ,属于加聚反应.
,属于加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NO2 | C. | PM2.5 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比为1:1 | B. | 密度比为11:16 | C. | 体积比为16:11 | D. | 体积比为11:16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com