
从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是 ( )
A.Cu + HNO3(浓)→ Cu(NO3)2 B.Cu + HNO3(稀)→ Cu(NO3)2
C.Cu  CuO
CuO 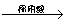 Cu(NO3)2 D.Cu + AgNO3 →Cu(NO3)2
Cu(NO3)2 D.Cu + AgNO3 →Cu(NO3)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化合物Ⅴ是具有抗氧化和抗肿瘤作用成分.化合物Ⅴ也可通过图所示方法合成:


已知 、
、
(1)反应①的类型________
(2)化合物Ι的分子式________
(3) ①A的结构简式_______。
② 1molV最多消耗NaOH ____。1mol肉桂酸最多消耗H2 _______mol
(4)化合物I和Ⅱ反应还可以得到一种酯,该反应的化学方程式是
(5)关于Ⅴ的说法正确的是( )
A.分子中有三个苯环 B.能发生水解反应
C.使酸性KMnO4溶液褪色 D.与FeCl3发生显色反应
(6)写出肉桂酸的一种同分异构体的结构简式 ,满足一下两个条件:
①分子中含有苯环 ②羧基与苯环直接相连
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香烃是指 ( )
A.分子里含有苯环的化合物 B.分子组成符合CnH2n-6 通式的一类有机物
C.分子里含有一个或多个苯环的烃 D.苯和苯的同系物的总称
查看答案和解析>>
科目:高中化学 来源: 题型:
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应。

先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少。
(1)请写出上述过程A装置中所涉及的化学反应方程式。
______________________________________________;
______________________________________。
(2)张老师认为装置设计有误,你认为_________(填“A”、 “B”或“C”)部分有误。
(3)B中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式:___ _____________________________________________。
(4)装置C的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:

请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
A. 为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D. KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O=_______ Fe(OH)3(胶体)+_______O2↑+_______OH-。
 (5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,
其装置如右图所示。电解过程中阳极的电极反应式为________。
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池
的负极反应式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和1.01×105 Pa时,反应2N2O5 (g) = 4NO2 (g)+O2 (g) ΔH=+56.76kJ/mol自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com