
【题目】下列离子方程式正确的是( )
A. 醋酸和碳酸钙反应:2H++CaCO3=Ca2++CO2↑+H2O
B. 铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+
C. 氢氧化钠溶液与少量二氧化硫气体:SO2+2OH-=SO32-+=H2O
D. 氯化铝溶液与足量氨水:Al3++=4NH3·H2O=AlO2-+=4NH4++2H2O
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值________(填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________进行(填“左”或“右”).
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.

①反应开始至平衡,氢气的平均反应速率v(H2)=__________,CO2的转化率为_______.
该温度下上述反应的平衡常数K=____________(分数表示).
②反应达到平衡后,下列能使![]() 的值增大的措施是_________(填符号)。
的值增大的措施是_________(填符号)。
a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________。
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明末宋应星的著书《天工开物》中记载了我国古代炼锌的方法,用炉甘石(主要成分是ZnCO3)和木炭混合加热分两步反应得到锌,写出其中氧化还原反应的化学方程式_____________。
现代工业上利用锌焙砂提炼金属锌的流程如下图所示(已知:①锌焙砂的主要成分是ZnO、ZnFe2O4,还含有少量FeO、CuO、NiO杂质;②金属活动性顺序:Zn>Ni>Cu),请回答下列问题:

(2)化合物ZnFe2O4中Fe的化合价为_________,酸浸时,ZnFe2O4发生反应的化学方程式为________。
(3)净化I操作分两步:首先用H2O2处理酸浸液,然后用物质A调节溶液的PH使Fe3+转化为Fe(OH)3沉淀过滤后除去。
①写出用H2O2处理酸浸液时发生反应的离子方程式______________。
②下图中的斜线是溶液中金属阳离子浓度(纵标)随pH值(横标)变化时的沉淀溶解平衡线,若加入物质A只使Fe3+沉淀完全,则物质A可能是_____________(填出一种可能的化学式),调节后溶液的pH应控制在______________范围内(假设杂质离子浓度均不大于0.1mol· L-1 )。
③此流程中没有用调节pH来除去Cu2+的原因是_____________。

(4)净化II欲分离出Cu、Ni,加入的B物质的化学式_____________。
(5)本流程中可以循环利用的化合物有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充人a mol CO与6 molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②X=___________(用含a、b的式子表示),p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为了T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为
A、单质 B、分子 C、元素 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图。下列有关说法正确的是

A. 该电池的总反应为C+O2=CO2
B. 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C. 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D. 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
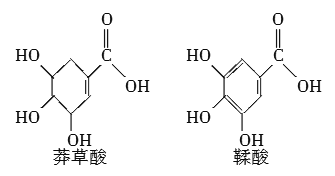
A.两种酸都能与溴水发生加成反应
B.两种酸与三氯化铁溶液都能发生显色反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量的金属钠反应产生氢气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)![]() bM(g),N、M的物质的量随时间的变化曲线如图所示:
bM(g),N、M的物质的量随时间的变化曲线如图所示:
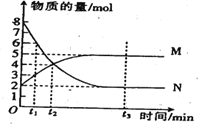
(1)此反应的化学方程式中a:b=________。
(2)t1到t2时,以N的浓度变化表示的平均反应速率为:___________mol·L-1· min-1。
(3)图中哪一时刻反应已经达到限度(____)
A.t1 B.t2 C.t3
(4)其他条件不变时,能使反应速率加快的是(____)
A.升高温度
B.容器体积固定不变时,充入He
C.容器体积固定不变时,充入气体N
D.容器内气体压强不变时,充入Ar
E.容器体积增大为原来的2倍
(5)若N为有色气体,且容器体积恒定,下列结论不能说明上述反应在该条件下已经达到反应限度的是(____)
A.M的消耗速率与N的生成速率之比为1:2
B.容器内气体的压强不再变化
C. N的消耗速率与M的消耗速率之比为2:1
D.容器内气体的质量不再变化
E.N的物质的量浓度不再改变
F.容器内气体的颜色不再改变
G.容器内气体的平均相对分子质量不再变化
H.容器内气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com