
��NAΪ�����ӵ�������ֵ������������ȷ���ǣ�������
| �� | A�� | ��״���£�11.2 L�Ҵ��������ǻ���Ϊ0.5NA |
| �� | B�� | �����£�1L 0.1 mol•L��1��Na2CO3��Һ�к��е���������Ϊ0.3NA |
| �� | C�� | ���³�ѹ�£�5.6g��ϩ�ͻ�����Ļ�������к��е�̼ԭ����Ϊ0.4NA |
| �� | D�� | �������ͭ��Һʱ������ÿ���ɱ�״����3.36L���壬��·��ת�Ƶ�����Ϊ0.3NA |
| �����ӵ�������. | |
| ר�⣺ | �����ӵ������Ͱ����ӵ����ɣ� |
| ������ | A������£��Ҵ���Һ�壬�������Ҵ������ʵ����� B��̼������Һ��̼�������ˮ���������������ӣ���Һ�������������� C��������ϩ�ͻ���������ʽ�����5.6g����ﺬ�е�̼ԭ����Ŀ�� D���������������ʵ����������غ�����ת�Ƶĵ������� |
| ��� | �⣺A���ڱ�״���£��Ҵ��������壬������11.2L�Ҵ������ʵ�������A���� B��1L 0.1 mol•L��1��Na2CO3��Һ�к�������̼����0.1mol��̼������Ӳ���ˮ�⣬��Һ����������Ŀ���࣬������Һ�к��е����������ʵ�������0.3mol��������������0.3NA����B���� C����ϩ�ͻ���������ʽΪCH2��5.6g������庬��0.4mol���ʽ������0.4mol̼ԭ�ӣ����е�̼ԭ����Ϊ0.4NA����C��ȷ�� D���������ͭ��Һʱ���������ɵ�����������״����3.36L��������ʵ���Ϊ0.15mol��ת�Ƶĵ��ӵ����ʵ���Ϊ0.6mol����·��ת�Ƶ�����Ϊ0.6NA����D���� ��ѡC�� |
| ������ | ���⿼���˰����ӵ��������йؼ�����жϣ���Ŀ�Ѷ��еȣ�ע���״�������ʵ�״̬�������ӵ�����������߿��ġ��ȵ㡱���⣬�����������ȿ�����ѧ�������ʵ�������������������������밢���ӵ�������ϵ�����⣬�ֿ��Ժ��Ƕ�ǶȵĻ�ѧ֪ʶ���ݣ�Ҫȷ����������Ŀ��һ��Ҫ���պ������ʵ���Ϊ���ĵĸ���ѧ���밢���ӵ������Ĺ�ϵ������ҪȷŪ����ӡ�ԭ�ӡ�ԭ�Ӻ����������Ӽ�������ӵĹ��ɹ�ϵ�� |
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£�0.2 m
�����£�0.2 m ol·L��1��һԪ��HA���Ũ��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����(����)
ol·L��1��һԪ��HA���Ũ��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����(����)
A��HAΪǿ��
B���û����ҺpH��7.0
C���û����Һ�У�c(A��)��c(Y)��c(Na��)
D��ͼ��X��ʾHA��Y��ʾOH����Z��ʾH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��25����������10.00 mL 0.1 mol·L-1HCOOH��Һ����μ���0.1 mol ·L-1NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)������˵���в���ȷ���ǡ�(����)
·L-1NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)������˵���в���ȷ���ǡ�(����)
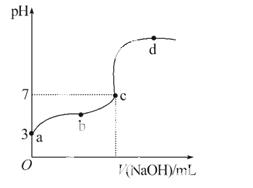
A.a���ʾ����Һ��c(HCOO-)ԼΪ10-3mol·L-1
B.��25 mL����ʽ�ζ�����ȡHCOOH��Һ
C.c��NaOH��Һ�����С��10 mL
D.��a��c����һ�㣬��Һ��һ������c(Na+)>c(HCOO-)>c(H+)> c(OH-)
c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪Co2O3��������Һ���ױ���ԭ��Co2+����Co2O3��Cl2��FeCl3��I2�����������μ��������������У���ȷ���ǣ�
��A��Cl2ͨ��FeI2��Һ�У��ɴ��ڷ�Ӧ3Cl2+6FeI2��2FeCl3+4FeI3
��B��ÿ1 mol Co2O3��������Һ�б���������Co2+ʱת��2 mol e-
mol Co2O3��������Һ�б���������Co2+ʱת��2 mol e-
��C��FeCl3��Һ��ʹ����- KI��ֽ����
��D��I2���н�ǿ���� ���ԣ����Խ�Co2+������Co2O3
���ԣ����Խ�Co2+������Co2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1) �ڱ�״���£����1.32 gij��������Ϊ0.672 L����������Ħ������Ϊ ��
(2)������CO��CO2��������ĵ�Ħ������֮��Ϊ ��ͬ��ͬѹ�µ������Ϊ ��������Ԫ�ص�ԭ�Ӹ�����Ϊ ��
(3)����ʳ�׳�ȥˮ���е�ˮ��,��������þΪ����������Ӧԭ���������ӷ���ʽ��ʾ����
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ֱ�������4�����ʵĴ�����Ʒ���������ʵ�����������ͬʱ��ȡ��������������Ʒ����Ũ����ͬ�����ᷴӦ�����������������ɶൽ�ٵ�˳���ǣ�������
���ʣ���NaOH����Ca��OH��2����NaHCO3����CaCO3��
| �� | A�� | �٢ڢܢ� | B�� | �ۢܢ٢� | C�� | �ڢ٢ܢ� | D�� | �ܢۢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijFeSO4��Fe2��SO4��3��H2SO4�Ļ����Һ100mL����֪��Һ�������ӵ�Ũ����ͬ��������ˮ�⣩����SO42�������ʵ���Ũ��Ϊ6mol/L�������Һ�����ܽ����۵�����Ϊ��������
| �� | A�� | 11.2 g | B�� | 16.8 g | C�� | 19.6 g | D�� | 22.4 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���ǣ�������
| �� | A�� | ��1 mol���ʵ��κ���Һ�����ʵ���Ũ��һ����� |
| �� | B�� | ����1 mol/L NaCl��Һ1 L���䷽���ǣ���58.5 g NaCl����1 Lˮ�м��� |
| �� | C�� | �����ͬ�����ʵ���Ũ����ͬ��ͬ����Һ�������ʵ�������һ����ͬ |
| �� | D�� | 1 L 0.5 mol/L CaCl2��Һ�У�Ca2+��Cl﹣�����ʵ���Ũ�ȶ���0.5 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ֻ�����Ӧ�����У�һ����������ԭ��Ӧ���ǣ� ��
A�����Ϸ�Ӧ B���ֽⷴӦ C���û���Ӧ D�����ֽⷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com