
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| C、0.1L lmol?L-1Na2CO3溶液中,阴离子总数小于0.1NA |
| D、50ml、l8.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| m |
| M |
| m |
| M |
| 14g |
| 28g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| 1 | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| 2 | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| 3 | 苛性钠 | 醋酸 | 石灰石 | 水 |
| 4 | 苛性钾 | 碳酸 | 苏打 | 三氧化硫 |
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和Na2CO3与HCl和NaHCO3 |
| B、AgNO3和HCl与AgNO3和H2SO4 |
| C、BaCl2和Na2SO4 与Ba(OH)2和CuSO4 |
| D、KOH和CuCl2与Ba(OH)2和CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质的质量增大 |
| B、溶质的物质的量浓度增大 |
| C、Ca(OH)2浓度不变 |
| D、溶质的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2、CO2(CO)
| |||||
B、H2(CO2、HCl)
| |||||
C、O2(CO)
| |||||
D、CO(H2O、CO2)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠是银白色金属,硬度很大 |
| B、金属钠的熔点很高,密度比CCl4大 |
| C、将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出 |
| D、金属钠保存在煤油中,使用剩下的金属钠仍放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、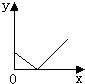 |
B、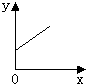 |
C、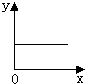 |
D、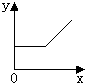 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料袋在全球“失宠”,是因为塑料袋填埋占用土地,且难以降解 |
| B、举行“地球一小时”熄灯活动,会影响经济发展及社会生活,所以不宜推广 |
| C、有色玻璃是某些胶态金属分散于玻璃中制成的胶体 |
| D、太阳能是目前人类生产生活直接利用的、转化效率最高的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com