
| A. | 为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 该反应中氧化剂与还原剂物质的量之比为8:1 | |
| C. | 若有1molNO3-发生氧化反应,则转移电子5mol | |
| D. | 该反应中Fe2+是还原剂,NH4+是还原产物 |
分析 亚铁离子具有还原性,酸性条件下硝酸根离子具有强氧化性,二者发生氧化还原反应生成铁离子、铵根离子,其反应方程式为8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,以此解答该题.
解答 解:反应的方程式为8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,
A.酸性条件下发生氧化还原反应,不能用酸酸化,故A错误;
B.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,氧化剂和还原剂的物质的量之比为1:8,故B错误;
C.反应中N元素化合价由+5价降低到-3价,则若有1molNO3-发生氧化反应,则转移电子8mol,故C错误;
D.由化合价变化可知该反应中Fe2+是还原剂,NH4+是还原产物,故D正确.
故选D.
点评 本题考查氧化还原反应,侧重考查学生分析、推断能力,正确判断反应物、生成物是解本题关键,能正确写出相应的离子方程式,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
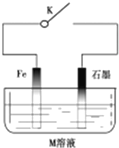
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含3.01×1023个氮原子的N2 | B. | 标准状况下11.2 L H2 | ||
| C. | 1 mol Na2SO4中的Na+ | D. | 常温常压下32 g O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com