
【题目】海水是重要的资源,可以制备一系列物质,
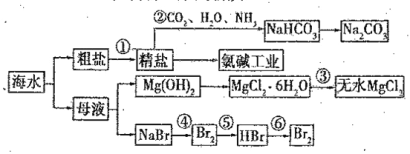
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
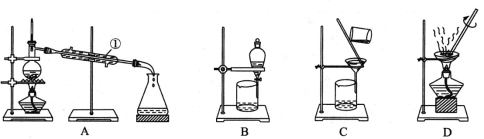
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 。该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,取少量海水在实验室中进行如下流程的实验:
![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是 (填写序号)。
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦
C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
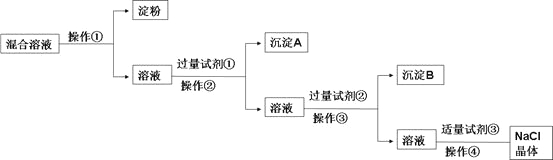
(1)写出上述实验过程中所用试剂(写化学式):
试剂①___________________;试剂③________________。
(2)判断试剂①已过量的方法是:________________________。
(3)用化学方程式表示加入试剂②的作用:_______________________。
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉_____________(填“能”或“不能”)透过半透膜;SO42-_____________(填“能”或“不能”)透过半透膜;请用实验证明上述结果,完成下表(可不填满,也可增加):限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号 | 实验操作 | 预期现象和结论 |
① | ||
② |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4H2O含有的结晶水分子数为0.02NA (2CaSO4H2O式量为290);
⑥1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如右图所示,对该反应的推断合理的是( )
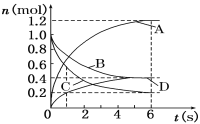
A.该反应的化学方程式为3B+4D ![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S203+H2S04=Na2S04+S02+S↓+H20,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度℃ | Na2SO4 | Na2S2O3 溶液 | 稀 H2SO4 | H2O | |
V/mL | c/ (moL-L-1) | V/mL | d (moL-L-1) | V/mL | ||
A | 25 | 5 — | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
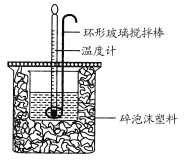
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________________________
(2)倒入NaOH溶液的正确操作是______________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________。
(5)______________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[ Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量 Mg(ClO3)2·6H2O 的流程如下:
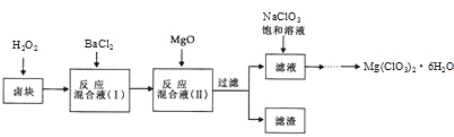
已知:①.卤块主要成分为 MgCl2·6H2O,含有 MgSO4、FeCl2等杂质。
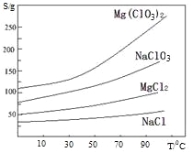
②.四种化合物的溶解度(S)随温度(T)变化曲线 如图所示。回答下列问题:
(1).过滤时主要的玻璃仪器有
(2).加入 BaCl2 的目的是除去杂质离子,检验已沉淀完全的方法是
( 3) .加入 H2O2 溶 液 的 作 用 是 : ; 加 入 MgO的 作 用是
(4).滤渣的主要成分为 。
(5).向滤液中加入 NaClO3 饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取 Mg(ClO3)2·6H2O 的实 验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6).产品中 Mg(ClO3)2·6H2O 含量的测定:
步骤 1:准确称量 3.50 g 产品配成 100 mL 溶液。
步骤 2:取 10.00 mL 于锥形瓶中,加入 10.00 mL 稀硫酸和 20.00mL 1.000 mol·L-1 的 FeSO4溶液,微热。
步骤 3:冷却至室温,用 0.l000mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤 4:将步骤 2、3 重复两次,计算得平均消耗 K2Cr2O7 溶液 15.00 mL。
写出步骤 2 中发生反应的离子方程式(还原产物为Cl- )
产品中 Mg(ClO3)2·6H2O 的质量分数为【Mg(ClO3)2·6H2O 的相对分子质量为299,列出表达式即可)】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com