
| A. | CH3-CH=CH2和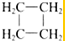 | B. |  和 和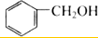 | ||
| C. | 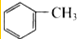 和 和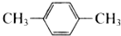 | D. | CH3-CH2-CH=CH2和CH2=CH-CH=CH2 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物.
解答 解:A、CH3-CH=CH2为烯烃,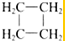 为环烷烃,结构不相似,不是同系物,故A错误;
为环烷烃,结构不相似,不是同系物,故A错误;
B、羟基直接连在苯环上为酚,羟基与烃基相连为醇类,两者不是同系物,故B错误;
C、 为甲苯,
为甲苯, 为对二甲苯,两者结构相似,分子组成上相差1个CH2原子团,属于同系物,故C正确;
为对二甲苯,两者结构相似,分子组成上相差1个CH2原子团,属于同系物,故C正确;
D、CH3-CH2-CH=CH2为单烯烃,CH2=CH-CH=CH2为二烯烃,两者结构不相似,不是同系物,故D错误,故选C.
点评 本题主要考查的是同系物的概念,互为同系物的分子式一定不相同,结构相似.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 | |
| C. | 正反应速率和逆反应速率都减小,平衡向正反应方向移动 | |
| D. | 正反应速率和逆反应速率都减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
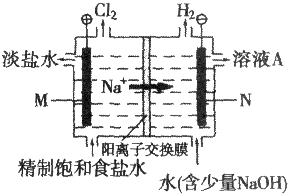
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
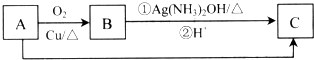
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
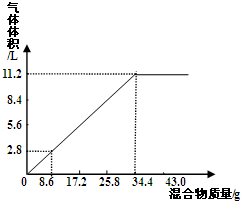
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
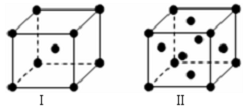 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com