
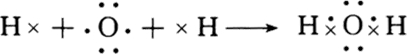 、
、
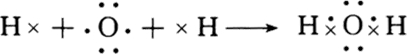 、
、
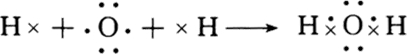 ,
, ,
,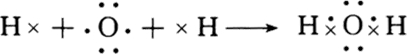 ;
; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
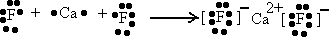
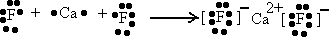
| 元素 | 实验设计 | 现象 | 结论 |
| B | 金属性:B > > F(填“>”、“<”或“=”) | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
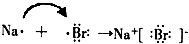
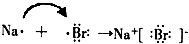
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
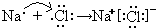
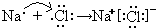
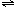 NH3?H2O+H+
NH3?H2O+H+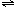 NH3?H2O+H+
NH3?H2O+H+ BiOCl+2HCl
BiOCl+2HCl BiOCl+2HCl
BiOCl+2HCl查看答案和解析>>
科目:高中化学 来源: 题型:
反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如下,虚框内是需设计的内容,反应物只能用A~N中的物质。请回答下列问题:
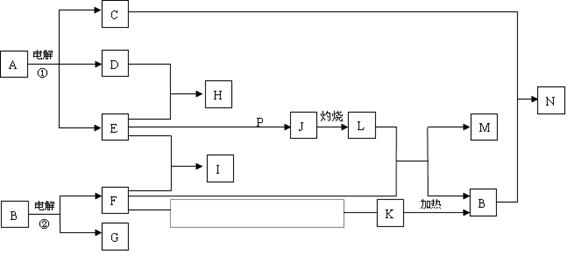
(1)用电子式表示H物质的形成过程
(2)电解池①中的阴极产物的名称
(3)足量的E与P溶液反应生成J,离子方程式为
(4)N溶液呈碱性,用离子方程式解释原因
(5)请模仿上述物质转化关系图设计F→K的最佳途径:(用A~N中的物质的化学式表示)
 |
F — →K
按设计得到1molK,至少需要另加的试剂及其物质的量是
n( )= mol;n( )= mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省张掖二中高一下学期期中考试化学试卷 (带解析) 题型:填空题
(28分,每空2分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | | | | | | | B |
| 2 | | | | D | E | F | J | |
| 3 | C | | | G | | H | I | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com