

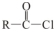 +R′OH→
+R′OH→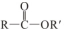 +HCl
+HCl
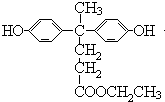 .
.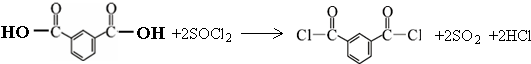 .
. 的路线.
的路线.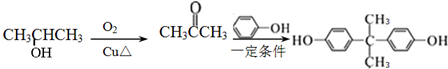 .
. 分析 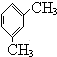 被酸性高锰酸钾氧化生成C为
被酸性高锰酸钾氧化生成C为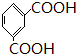 ,C中羧基上的羟基被氯原子取代生成D为
,C中羧基上的羟基被氯原子取代生成D为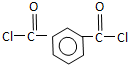 ,由聚芳酯E的结构可知B为
,由聚芳酯E的结构可知B为 ,逆推可知A为
,逆推可知A为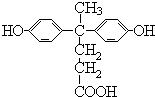 .
.
(5)结合转化关系中乙酰丙酸与苯酚转化为A的反应,可知2-丙醇氧化生成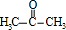 ,丙酮与苯酚反应得到
,丙酮与苯酚反应得到 .
.
解答 解: 被酸性高锰酸钾氧化生成C为
被酸性高锰酸钾氧化生成C为 ,C中羧基上的羟基被氯原子取代生成D为
,C中羧基上的羟基被氯原子取代生成D为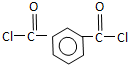 ,由聚芳酯E的结构可知B为
,由聚芳酯E的结构可知B为 ,逆推可知A为
,逆推可知A为 .
.
(1)A为 ,含有的官能团是:羧基、羟基,故答案为:羧基、羟基;
,含有的官能团是:羧基、羟基,故答案为:羧基、羟基;
(2)B与D发生缩聚反应生成聚芳酯(PAR),B的结构简式为  ,
,
故答案为:缩聚反应; ;
;
(3)C生成D的反应化学方程式为: ,
,
故答案为: ;
;
(4)C的结构简式为 ,核磁共振氢谱中有4个吸收峰,同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为-OH、-COOH、-CHO,当-OH、-COOH处于邻位时,-CHO有4种位置,当-OH、-COOH处于间位时,-CHO有4种位置,当-OH、-COOH处于对位时,-CHO有2种位置,共有10种,
,核磁共振氢谱中有4个吸收峰,同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为-OH、-COOH、-CHO,当-OH、-COOH处于邻位时,-CHO有4种位置,当-OH、-COOH处于间位时,-CHO有4种位置,当-OH、-COOH处于对位时,-CHO有2种位置,共有10种,
F与C属于官能团异构的同分异构体,且只含一种官能团,则F为含有2个-OOCH,水解得到2mol羧基、2mol酚羟基,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为4mol,
故答案为:4;10;4mol;
(5)结合转化关系中乙酰丙酸与苯酚转化为A的反应,可知2-丙醇氧化生成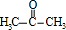 ,丙酮与苯酚反应得到
,丙酮与苯酚反应得到 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物推断与合成、有机物的结构与性质、限制条件同分异构体书写等,侧重考查学生分析推断能力,注意根据反应条件及物质的结构采取正、逆推法相结合推断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和Na2CO3溶液洗涤后分液 | D. | 用过量NaCl溶液洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
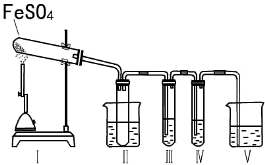
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少一点为3.2g | |
| B. | 0.5L1mol•L-1NaHS的溶液中,Na+和HS-离子数目之和为NA | |
| C. | 25℃时,7gC2H4和C2H6混合气体中,含有NA个C-H键 | |
| D. | 标况下,11.2L一氯甲烷中含有的氯原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| B. | ③④处于同一周期 | |
| C. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用粮食发酵制取 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与乙醛互为同分异构体 | D. | 通过取代反应可以制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性强弱:KOH>NaOH>LiOH | B. | 原子半径大小:Na>S>O | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醇完全燃烧生成3mol水 | |
| B. | 乙醇能与水以任意比例互溶 | |
| C. | 乙醇沸点较高 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com