
| 10-14 |
| 0.1 |
| 4.0×10-14 |
| 5.0×10-4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯乙烷制乙烯是消去反应 |
| B、苯的同系物能使溴水褪色说明烃基对苯环的性质产生了较大的影响 |
| C、除去电石和水反应产生的乙炔中杂质气体,可用氢氧化钠溶液 |
| D、卤代烃与氢氧化钠的乙醇溶液反应后留下的混合物加硝酸酸化后加硝酸银溶液,可以根据生成沉淀的颜色判断卤素种类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ag+ Mg2+ Ba2+ | ||||||||
| 阴离子 | NO
|
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为: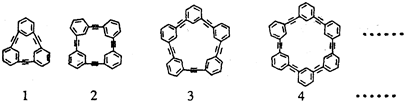
 )为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | C2H6 | CO32- | C2O42- | ||
| NH4+ | N2H62+ | NO2+ | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
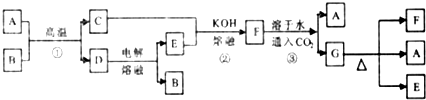
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com