
| A. | Zn为负极,Ag2O是正极 | |
| B. | 在使用过程中,电池负极区溶液的c(OH-)值减小 | |
| C. | 电池工作时,电子由Zn极经外电路流向Ag2O极 | |
| D. | 电路中每通过0.2mol电子,负极的质量理论上减少6.5g |
分析 A.电极反应中失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极;
B.负极上氢氧根离子参加反应导致溶液负极附近溶液的pH降低;
C.放电时,电子从负极沿导线流向正极,电流从正极流向负极;
D.根据Zn和转移电子之间的关系式计算消耗锌的质量.
解答 解:A.电极反应中失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据电极反应式得失电子知,Zn为负极,Ag2O是正极,故A正确;
B.在使用过程中,电池负极区溶液中OH-参加反应导致溶液中c(OH-)值减小,故B正确;
C.放电时,电子从负极沿导线流向正极,即从Zn电极经外电路流向Ag2O极,故C正确;
D.根据负极反应式知,锌电极上失电子和氢氧根离子反应生成ZnO导致负极质量增加,负极增加的质量=$\frac{0.2mol}{2}×16g/mol$=1.6g,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,知道放电时电子流向、各个电极与电子之间的关系,易错选项是D,注意放电时负极质量增加而不是减少,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 分馏石油得到的各馏分都是纯净物 | |
| C. | C4H10有2种同分异构体 | |
| D. | 蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的简化电子排布式:[Ar]4s1 | |
| C. | N原子的电子排布图: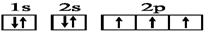 | |
| D. | S原子的电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )| A. | 3:4:1 | B. | 5:4:1 | C. | 3:5:1 | D. | 3:5:0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,系统命名的名称为2,3-二甲基-2-丁烯.
,系统命名的名称为2,3-二甲基-2-丁烯.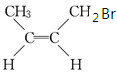 反式
反式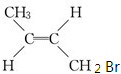 若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.
若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的某些共价化合物的熔点高于某些金属单质的熔点 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| D. | 由短周期非金属元素形成的纯净物中,相邻原子之间最多只能共用2对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
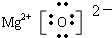 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9gD2O和9gH2O中含有的质子数均为5NA | |
| B. | 2L0.5mol/LH2SO3溶液中含有的H+数小于2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com