
 由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.
由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物. 分子内的作用力没有B (填编号).
分子内的作用力没有B (填编号).分析 (1)CO是直线形分子,其结构和氮气相似;原子个数相等、价电子数相等的微粒是等电子体;
(2)分子晶体熔沸点较低;
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成 NH3,两个氨气分子可能位于平行四边形相邻、相对位置或八面体上下两个顶点上;
(4)配合物中非金属元素之间存在共价键,O原子和另外-OH中H原子之间存在氢键,含有空轨道的原子和含有孤电子对的原子之间存在配位键.
解答 解:(1)CO是直线形分子,其结构和氮气相似;原子个数相等、价电子数相等的微粒是等电子体,与CO互为等电子体的分子和离子有N2、CN-,
故答案为:直线形;N2;CN-;
(2)分子晶体熔沸点较低,Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点较低,为分子晶体,故答案为:分子晶体;
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成 NH3,两个氨气分子可能位于平行四边形相邻、相对位置或八面体上下两个顶点上,所以得到新的配合物有3种,故答案为:3;
(4)配合物中非金属元素之间存在共价键,O原子和另外-OH中H原子之间存在氢键,含有空轨道的原子和含有孤电子对的原子之间存在配位键,该配合物中C-N、C-C、C-H、N-O、H-O中都为共价键,Ni原子和N原子之间存在配位键,O原子和另外-OH中H原子形成氢键,但该物质中不含离子键,故选B.
点评 本题考查化学键、等电子体、分子晶体判断等知识点,为高频考点,侧重考查学生分析判断及空间想象能力,知道氢键、配位键形成条件,难点是(3)中配合物结构判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 实验结论 |
| A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质一定是钠盐 |
| B | 将SO2分别通入溴水、酸性高锰酸钾溶液、品红溶液中,溶液均褪色 | 均能证明SO2具有漂白性 |
| C | 向某溶液中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口,试纸变蓝 | 该溶液中存在NH4+ |
| D | 蔗糖溶液中加入少量稀硫酸加热,然后直接加银氨溶液再加热,无银镜产生 | 证明蔗糖未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
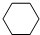 ,名称是环己烷.
,名称是环己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL 容量瓶配制所需的95 mL 0.1 mol•L-1 NaOH溶液 | |
| B. | 用50mL烧杯准确量取30.5 mL NaOH溶液 | |
| C. | 用托盘天平称取25.30gNaCl | |
| D. | 用50 mL 量筒量取4.8 mL浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com