
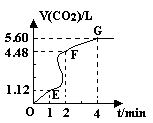
 £ØĘųĢåĢå»ż¾łŌŚ±ź×¼×“æöĻĀ²ā¶Ø£©”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£ØĘųĢåĢå»ż¾łŌŚ±ź×¼×“æöĻĀ²ā¶Ø£©”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ| A£®ÕōĮóĖ® | B£®ĀČ»Æ¼Ų¹ĢĢå | C£®ĀČ»ÆÄĘČÜŅŗ | D£®ÅØŃĪĖį |
 £Ø3£©¼ÓČėCaCO3µÄÖŹĮæĪŖ ”£
£Ø3£©¼ÓČėCaCO3µÄÖŹĮæĪŖ ”£

 ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®Ķ¼¢Ł±ķŹ¾Ņ»¶ØĢõ¼žĻĀij»Æѧ·“Ó¦µÄĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒ÷ŹĘĶ¼£¬øĆ·“Ó¦Ņ»¶ØĪŖ·ÅČČ·“Ó¦ |
| B£®Ķ¼¢ŚÖŠĒśĻß±ķŹ¾½«ĒāŃõ»ÆÄĘČÜŅŗµĪ¼Óµ½“×ĖįČÜŅŗÅØ¶ČµÄ±ä»ÆĒ÷ŹĘĶ¼ |
| C£®Ķ¼¢Ū±ķŹ¾µČĢå»ż”¢µČĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįŗĶ“×Ėį£¬·Ö±š¼Ó×ćĮæĆ¾·Ū£¬²śÉśH2µÄĪļÖŹµÄĮæµÄ±ä»Æ |
| D£®Ķ¼¢ÜĪŖĖ®µÄµēĄėĘ½ŗāĒśĻßĶ¼£¬Čō“ÓAµćµ½Cµć£¬æɲÉÓĆŌŚĖ®ÖŠ¼ÓČėŹŹĮæNaOH¹ĢĢåµÄ·½·Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
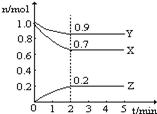
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
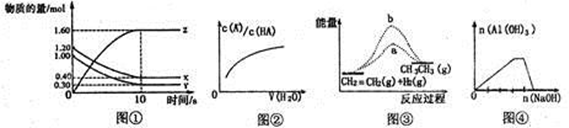
| A£®Ķ¼¢Ł±ķŹ¾T”ꏱ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻß”£ČōT”ꏱ£¬ČōĘšŹ¼Ź±XĪŖ1.20mol£¬YĪŖ1.00mol£¬ŌņĘ½ŗāŹ±YµÄ×Ŗ»ÆĀŹĪŖ80% |
| B£®Ķ¼¢ŚÖŠĒśĻß±ķŹ¾ĻņČõĖįHAµÄĻ”ČÜŅŗÖŠ¼ÓĖ®Ļ”ŹĶ |
| C£®Ķ¼¢ŪbĒśĻß±ķŹ¾·“Ó¦CH2=CH2(g)+H2(g)”śCH3£CH3(g) ”÷H<0£¬Ź¹ÓĆ“ß»Æ¼ĮŹ±£¬·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ |
| D£®Ķ¼¢Ü±ķŹ¾ĻņNH4Al(SO4)2ČÜŅŗÖŠµĪ¼Ó¹żĮæµÄNaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 4NO(g)+ 6H2O(g)£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
4NO(g)+ 6H2O(g)£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ| A£®“ļµ½»ÆŃ§Ę½ŗāŹ±£¬¦ŌÕż£½¦ŌÄę£½0 |
| B£®Čōµ„Ī»Ź±¼äÄŚÉś³Éx mol NOµÄĶ¬Ź±£¬ĻūŗÄx mol NH3 £¬Ōņ·“Ó¦“ļµ½Ę½ŗāדĢ¬ |
| C£®“ļµ½»ÆŃ§Ę½ŗāŹ±£¬ČōŌö“óČŻĘ÷Ģå»ż£¬ŌņÕż·“Ó¦ĖŁĀŹ¼õÉŁ£¬Äę·“Ó¦ĖŁĀŹŌö“ó |
| D£®“ļµ½»Æѧ·“Ó¦Ę½ŗāŗó£¬øıäĢõ¼žµ±¦ŌÕż£¾¦ŌÄę£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 Z(g)£¬¾60s“ļµ½Ę½ŗā£¬Éś³É0.3molZ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
Z(g)£¬¾60s“ļµ½Ę½ŗā£¬Éś³É0.3molZ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©| A£®·“Ó¦½ųŠŠ60sŹ±£¬X”¢Y”¢ZµÄÅضČĻąµČ |
| B£®·“Ó¦½ųŠŠ80sŹ±£¬Äę·“Ó¦ĖŁĀŹ“óÓŚÕż·“Ó¦ĖŁĀŹ |
| C£®ŅŌXÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.06mol£Æ(L?min) |
| D£®·“Ó¦½ųŠŠ80sŹ±£¬YĪļÖŹµÄĮæÅضČĪŖ0.03mol£ÆL |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
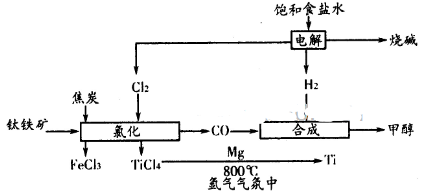
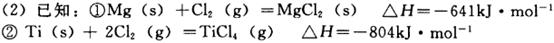
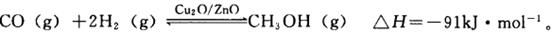
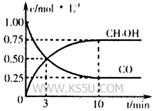
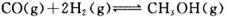 µÄ»ÆŃ§Ę½ŗā³£
µÄ»ÆŃ§Ę½ŗā³£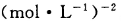 ”£
ӣ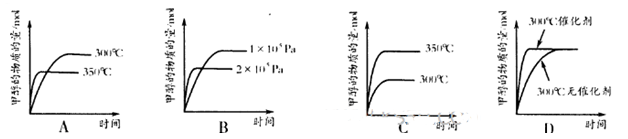
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2NO2µÄĘ½ŗā”£ĻĀĶ¼ŹĒøōŅ»¶ØŹ±¼ä²ā¶Øµ½µÄN2O4µÄÅØ¶Č£Øׯ×ų±źĪŖN2O4µÄÅØ¶Č£¬ŗį×ų±źĪŖŹ±¼ä£©
2NO2µÄĘ½ŗā”£ĻĀĶ¼ŹĒøōŅ»¶ØŹ±¼ä²ā¶Øµ½µÄN2O4µÄÅØ¶Č£Øׯ×ų±źĪŖN2O4µÄÅØ¶Č£¬ŗį×ų±źĪŖŹ±¼ä£©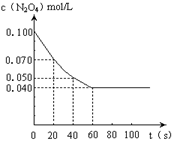
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 C(g)£¬¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾ŻČē±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
C(g)£¬¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾ŻČē±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com