
【题目】以下实验方案可以从海洋生物中提取具有抗肿瘤活性的天然物质:
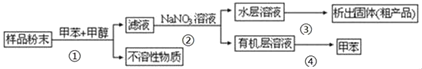
已知:甲苯,甲醇均为有机溶剂。
(1)指出抗肿瘤活性物质提取操作过程中有关的实验操作名称①_____④_____。
(2)操作①中用到的主要玻璃仪器有_____。
(3)操作②在用装置分液漏斗进行操作时,为使液体顺利滴下,应进行的具体操作是_____。 分液时要注意及时_____,防止上层液体流下。分液后漏斗内剩余的液体从分液漏斗 的_____(填“上口”或“下口”)倒入烧杯。
【答案】过滤 蒸馏 玻璃棒、漏斗及烧杯 打开上口瓶塞(或凹槽对小孔) 关闭活塞 上口
【解析】
步骤①是分离固液混合物,其操作为过滤,步骤②分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤③是从水溶液中得到固体,操作为蒸发,需要蒸发皿;步骤④是从有机化合物中利用沸点不同采取蒸馏得到甲苯,以此来解答。
(1)由分析可知,操作①为固液分离,是过滤;操作④是将互相溶解的液体混合物进行分离,应为蒸馏;
(2)操作①是分离固液混合物,其操作为过滤,需要用的玻璃仪器为玻璃棒、漏斗及烧杯;
(3)操作②在用装置分液漏斗进行分液操作时,为使分液漏斗中的液体顺利流出,应使压强内外相等,则应打开上口瓶塞(或凹槽对小孔),分液时要注意及时及时关闭活塞,避免上层液体从下口流出,分液后漏斗内剩余的液体从分液漏斗的上口倒出。


科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一,有关硫酸制备和性质实验如下:
Ⅰ.(1)早在1000多年前,我国就已采用加热胆矾或绿矾(FeSO47H2O)的方法制取硫酸。2FeSO4![]() Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式______;
Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式______;
(2)能说明SO2存在的实验现象是______。
Ⅱ.(3)实验室用图2装置制SO2,甲试管倾斜加热的目的是______,加热后试管内发生的化学方程式为______。
(4)有关该实验说法正确的是:______。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将冷却后试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)的平衡常数K=2.5×107
(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A.用浓硫酸干燥NH3
B.用乙醇萃取碘水中的碘单质
C.用加热的方法除去NaCl固体中的少量NaHCO3
D.用KSCN溶液鉴别Fe2(SO4)3溶液和FeCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是常见的几种元素,其相关信息如表:
元素 | 相关信息 |
X | 原子核外有 3 个电子层,最外层比次外层少 1 个电子 |
Y | 食盐中添加少量 Y 的一种化合物预防 Y 元素缺乏 |
Z | Z 与钾的一种合金可用于快中子反应堆作热交换剂 |
W | W 的一种核素质量数为 24,中子数为 12 |
(1)元素 X 在海水中含量非常高,海水中含 X 元素的主要化合物是_____。工业上制取 X单质的化学方程式为_____。
(2)设计实验证明某水溶液中存在 Y 单质_____。
(3)Z 的元素符号为_____,其原子结构示意图为_____。
(4)W 与空气中含量最高的气体反应的产物化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关物质制备的说法不正确的是( )
A.工业上电解饱和食盐水制取氯气、烧碱称为侯氏制碱法
B.工业上炼铁用CO做还原剂
C.工业上电解熔融的MgO制备金属镁
D.工业上用焦炭和二氧化硅高温下反应可制得粗硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对铁生锈进行研究。
(1)甲同学设计了 A、B、C三组实验如图:

探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是: A中铁钉生诱;b中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是______________________________;
②铁钉发生电化学腐蚀的正极电极反应式为______________________________;
③实验B所用的水要经过________处理,植物油的作用是_________________;
④实验C中碱石灰的作用是______________________。
(2)乙同学为了达到同样目的,设计了实验d如图所示:

发现一段时间后,试管中的液面升髙,其原因是____________________________,该实验_______(填“能”或“不能”)说明水对铁钉生锈产生影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或用品:①铁架台(含铁圈、各式铁夹)②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒(普通) ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩漏斗;
现有下列药品:a.NaOH固体 b.标准NaOH溶液 c.未知浓度盐酸 d.蒸馏水e.碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是______________。
(2)做中和反应反应热的测定实验时,还缺乏的玻璃仪器有____________、___________。
(3)准确量取25.00ml碳酸钠溶液,可选用的仪器是__________。
A.25ml量筒 B.25ml酸式滴定管
C.25ml碱式滴定管 D.有刻度的50ml烧杯
(4)进行中和滴定时,不可预先用待装液润洗的仪器是下列的__________(填编号)。
A、酸式滴定管 B、碱式滴定管 C、锥形瓶
(5)用标准强碱溶液滴定盐酸时,滴定前,滴定管尖端有气泡,滴定后气泡消失,会使得测定的盐酸浓度结果_____________。(填“偏高”、“偏低”或“不影响”,下同)
(6)用标准强碱溶液去滴定未知浓度盐酸,用滴定管取10.00ml盐酸溶液入锥形瓶时,前仰视、后俯视读数,会使得测定的盐酸浓度结果___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com