
【题目】能证明硫酸为强酸的实验事实是
A. 能与酸碱指示剂作用 B. 0.1mol/L的硫酸中,测得c(H+)=0.2mol/L
C. 能与金属锌反应生成氢气 D. 能与食盐固体共热产生气体氯化氢
科目:高中化学 来源: 题型:
【题目】以下一系列反应,最终产物为草酸(乙二酸)。
B![]() C
C![]() D
D![]() E
E![]() F
F![]()
![]()
已知B为某一溴代物。
(1)推测用字母代表的化合物的结构式:C_______________。
(2)E→F的化学方程式是______________________。
(3)写出E和草酸在一定条件下生成高分子化合物的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴及其化合物在生活和生产中都有重要应用,自然界中的溴绝大多数都分布在海洋中,从海水中提取溴是溴的最主要来源.
(1)海水中溴的主要存在形式是(填字母代号).
A.Br﹣
B.Br2
C.BrO﹣
D.BrO3﹣
(2)实验室若要直接浓缩海水时,下列仪器肯定不需要的是 . 
(3)工业上常将海水中的溴转化为单质,再用热空气吹出溴,采用以下两种方式吸收:
方法I、二氧化硫水溶液吸收,该方法中二氧化硫是(填“氧化剂”或“还原剂”).
方法II、纯碱溶液吸收法,生成物之一是NaBrO3 , 写出反应的化学方程式 .
(4)现有一份吸收了溴的无色溶液X,假定吸收剂和溴完全反应,通过下列实验可探究X是采用哪种方法吸收溴的(已知pH试纸遇酸变红,遇碱变蓝).
①用玻璃棒蘸取少量X点在pH试纸上,试纸呈色,证明X是采用方法I吸收的;另取少量X,依次加入稀硫酸和四氯化碳,充分振荡后静置,观察到溶液分层,(填“上”或“下”)层呈橙红色,有关反应的离子方程式为 , 证明X是采用方法II吸收的.
②请再设计一个实验验证X是采用方法I吸收溴所得的溶液 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是氧族部分元素的相关性质。
元素 性质 | 8O | 16S | 34Se | 52Te |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
原子半径 | 逐渐增大 | |||
单质与H2 反应情况 | 点燃时 易化合 | 加热 化合 | 加热 难化合 | 不能 直接化合 |
请回答下列问题:
(1)硒在周期表中位置____。
(2)碲的化合价可能有____。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是__________(填化学式)。
(4)氢硒酸有较强的____(填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生的化学方程式为_____________。
(5)氧族元素单质与H2反应过程中的焓变如图所示,其中a、b、c、d分别表示氧族中某一元素的单质。则b代表___,d代表___(均写单质名称)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,因发生氧化还原反应而不能大量共存的是
A.K+、H+、I-、MnO4-B.Fe3+、Fe2+、SO42-、NO3-
C.Al3+、Na+、SO42-、CO32-D.Fe3+、H+、SO42-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 试管内壁附着的硫可用二硫化碳溶解除去
B. 单质硫既有氧化性,又有还原性
C. 硫在空气中燃烧的产物是二氧化硫
D. 硫在过量纯氧中燃烧的产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: 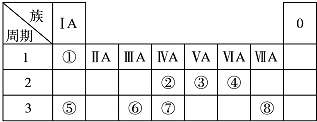
(1)地壳中含量最高的金属元素在周期表中的位置是 .
(2)⑧形成的单质与水反应的离子方程为 .
(3)②⑦的非金属性强弱可通过比较这两种元素(填编号)
a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式 .
(5)化工行业最近合成了由元素②和③形成的化合物,其硬度比金刚石还大.该物质所形成的晶体还可能具有的性质或特点有(填编号)
①熔点很高 ②可以导电 ③不存在单个分子 ④具有空间网状结构
(6)①和③形成的某液态化合物摩尔质量与氧气相同.在常温常压下0.25mol该液态物质在足量的氧气中完全燃烧生成③的气态单质和液态水,同时放出QkJ的热量.写出该反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米淀粉为原料生产燃料乙醇的生产过程可由下图表示:
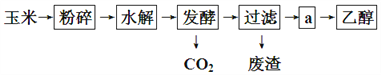
(1)乙醇分子中所含的官能团的名称为:__________________;
(2)过滤后得到a的主要成分为葡萄糖和乙醇,步骤a的操作是__________;
A.蒸发 B.萃取 C.蒸馏 D.分液
(3)生产过程中为了检验水解是否开始,可使用的试剂是______________;
(4)已知1g乙醇完全燃烧放出的热量为29.7kJ,请据此写出乙醇燃烧的热化学方程式:_______。
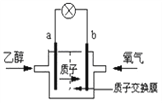
(5)为了充分利用乙醇的能量,科学家还把乙醇设计成燃料电池,如图,用磺酸类质子溶剂,在高温供电时,乙醇电池效率高且更安全。请判断,该电池的a极为电池的_______极(填“正”或“负”),b极的电极反应式为:____________________________,电池工作时,若有1mol乙醇被氧化,则转移的电子为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
(1)煤燃烧产生的SO2所形成的酸雨中,SO2 最终转化成的酸是________(填化学式),在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式:__________________________。
(2)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

(3)工业废水需处理达标后才能排放。下列废水处理的方法合理的是________ (填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(4)下列做法会加剧温室效应的是____________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
(5)空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是________ (填字母)。
a.CO2 b.N2 c.NO2
(6)选择环保的装修材料可以有效地减少居室污染。劣质胶合板释放的主要污染物是_______(填字母)。
a.NO b.CO c.甲醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com