
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
分析 A.氧气与钠反应生成过氧化钠,氧元素的化合价为-1价;
B.根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,Cu(OH)2从组成上可看成CuO•H2O,所以实际上相当于加入的物质是氧化铜和水;
C.根据反应方程式中的化合价变化分析、计算;
D.二者的摩尔质量都是142g/mol,142g混合物的物质的量为1mol,1mol二者的混合物中含有2mol钠离子、1mol硫酸根离子和硫酸氢根离子,总共含有3mol阴阳离子.
解答 解:A.标准状况下5.6L氧气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,0.25mol氧气与金属钠反应生成0.25mol过氧化钠,转移了0.5mol电子,转移电子数为0.5NA,故A错误;
B.加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,Cu(OH)2从组成上可看成CuO•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol,故B错误;
C.根据反应 ,当有5mol水参加反应时,水中氧元素失去电子是4mol,反应一共转移电子是6mol,由水还原的BrF3的物质的量为:2mol×$\frac{0.4mol}{0.6mol}$=$\frac{4}{3}$mol,故C错误;
,当有5mol水参加反应时,水中氧元素失去电子是4mol,反应一共转移电子是6mol,由水还原的BrF3的物质的量为:2mol×$\frac{0.4mol}{0.6mol}$=$\frac{4}{3}$mol,故C错误;
D.Na2SO4和Na2HPO4的摩尔质量都是142g/mol,142g Na2SO4和Na2HPO4固体混合物的物质的量为1mol,1mol该混合物中含有2mol钠离子、1mol硫酸根离子和1mol磷酸氢根离子,总共含有3mol阴阳离子,含有阴阳离子总数为3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度较大,明确物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积之间的关系为解答关键,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 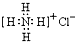 :可以表示氯化铵的电子式 :可以表示氯化铵的电子式 | |
| B. |  :可以表示中子数为18的氯原子结构示意图 :可以表示中子数为18的氯原子结构示意图 | |
| C. |  :可以表示乙醇分子的球棍模型 :可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应反映出物质的化学性质 | |
| B. | 所有金属及其化合物灼烧时火焰均有颜色 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
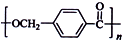 的路线:
的路线: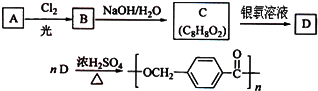

 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是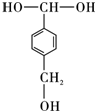 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com