

 ;HCl.
;HCl.分析 A是生活中常用的调味品,电解A得到B、C、D,B可在C中燃烧发出苍白色火焰,应氢气与氯气反应生成HCl,故A为NaCl、D为NaOH,X为HCl,B、C分别为氯气、氢气中的一种,E、H为生活中常见的金属单质,而H能与氢氧化钠反应,则H为Al,则K为NaAlO2,(6)中K和X恰好反应,L溶液显酸性,则L为AlCl3.金属E与C反应生成F,F与氢氧化钠反应生成G为红褐色沉淀,则C为Cl2、B为H2,E为Fe,F为FeCl3,G为Fe(OH)3,据此解答.
解答 解:A是生活中常用的调味品,电解A得到B、C、D,B可在C中燃烧发出苍白色火焰,应氢气与氯气反应生成HCl,故A为NaCl、D为NaOH,X为HCl,B、C分别为氯气、氢气中的一种,E、H为生活中常见的金属单质,而H能与氢氧化钠反应,则H为Al,则K为NaAlO2,(6)中K和X恰好反应,L溶液显酸性,则L为AlCl3.金属E与C反应生成F,F与氢氧化钠反应生成G为红褐色沉淀,则C为Cl2、B为H2,E为Fe,F为FeCl3,G为Fe(OH)3.
(1)C中元素为Cl,在元素周期表中的位置:第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)D为NaOH,电子式为 ,X为HCl,结构式为H-Cl,
,X为HCl,结构式为H-Cl,
故答案为: ;H-Cl;
;H-Cl;
(3)用惰性电极电解NaCl溶液的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)150mL 2mol/L的NaOH溶液中n(NaOH)=0.15L×2mol/L=0.3mol,4.48L(标准状况)CO2为$\frac{4.48L}{22.4L/mol}$=0.2mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2:1>n(NaOH):n(CO2)=3:2>1:1,故所得产物为Na2CO3和NaHCO3,
设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:
$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$
解得:x=0.1,y=0.1,
在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),水解程度微弱,碳酸根浓度远远大于氢氧根离子浓度,溶液中离子浓度大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)25℃时,Ksp[Fe(OH)3]=4.0×10-38,Fe3++3H2O?Fe(OH)3+3H+的平衡常数Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{({K}_{w})^{3}}{c(F{e}^{3+})•{c}^{3}(O{H}^{-})}$=$\frac{(1{0}^{-14})^{3}}{4×1{0}^{-38}}$=2.5×10-5,
故答案为:2.5×10-5;
(6)AlCl3溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液显酸性,
故答案为:Al3++3H2O?Al(OH)3+3H+.
点评 本题考查无机物的推断,涉及常用化学用语、电极反应式书写、离子浓度大小的比较、溶度积有关计算、盐类水解等知识点,根据特殊的现象、特殊反应进行推断,是对学生综合能力的考查,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
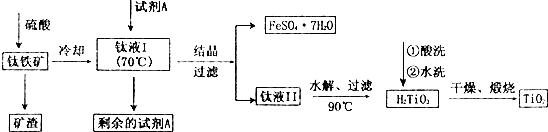
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | 碳酸钠溶液 | 氢氧化钡溶液 | 氧化铜粉末 |
| 现象 | 产生无色气体 | 产生白色沉淀 | 固体溶解 |
| A. | HCl | B. | CaCl2 | C. | MgSO4 | D. | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 | |
| B. | 因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 | |
| C. | 因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- | |
| D. | 因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 3种 | B. | 3种 2种 | C. | 3种 4种 | D. | 2种 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{20}}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{20}}$CH3CH2OH$→_{△}^{Cu/O_{2}}$CH3CHO$→_{△}^{新制银氨溶液}$CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com