
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
分析 ①表示铁与可溶性铜盐的反应;
②表示可溶性硫酸盐与可溶性钡盐的反应
③只能表示氯气和水的反应;
④表示可溶性碳酸盐与强酸的反应;
⑤表示硝酸银与可溶性氯化物的反应.
解答 解:①表示铁与可溶性铜盐的反应,例如铁与硫酸铜、硝酸铜反应,故不选;
②表示可溶性硫酸盐与可溶性钡盐的反应,例如硫酸钠、硫酸钾与氯化钡或者硝酸钡反应,故不选;
③只能表示氯气和水的反应,氯气与水反应生成氯化氢和次氯酸,故选;
④表示可溶性碳酸盐与强酸的反应,例如碳酸钠、碳酸钾与硫酸或者盐酸、硝酸的反应,故不选;
⑤表示硝酸银与可溶性氯化物的反应,例如硝酸银与氯化钾、氯化钠、盐酸反应,故不选;
故选:A.
点评 本题考查了离子方程式的书写,明确离子方程式书写方法及离子方程式的意义是解题关键,注意化学式的拆分,题目难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. |  除去HCl中含有的少量Cl2 | B. |  石油的蒸馏 | ||
| C. | 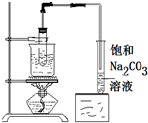 制备乙酸乙酯 | D. |  制备收集干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
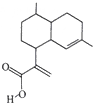 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
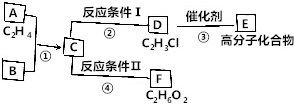 已知:
已知: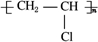 ,FCH2OHCH2OH.
,FCH2OHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
 .
. ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com