
分析 (1)根据方程式3NO2+H2O═2HNO3+NO,3mol二氧化氮与水反应生成2mol硝酸和1mol一氧化氮,转移了2mol电子;
(2)反应后的溶液质量增重=金属质量-生成氢气的质量,计算溶液质量增重进行判断;
(3)根据n=$\frac{V}{22.4L/mol}$计算出该气体的物质的量,再根据M=$\frac{m}{n}$计算出该气体的摩尔质量;
(4)根据电荷守恒进行计算;
(5)向某未知液中先滴加稀盐酸,无现象,说明不是碳酸根、亚硫酸根、银离子,再滴加氯化钡溶液,产生白色沉淀,则与钡离子形成白色沉淀,只能为硫酸根与其反应生成的硫酸钡.
解答 解:(1)因为根据方程式3NO2+H2O═2HNO3+NO,3mol二氧化氮与水反应生成2mol硝酸和1mol一氧化氮,转移了2mol电子,所以标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故答案为:0.2NA;
(2)把0.5mol钠投入到mg水(过量)中,则:
2Na+2H2O=2NaOH+H2↑
0.5mol 0.25mol
故溶液质量增重=0.5mol×23g/mol-0.25mol×2g/mol=11g,
把0.5mol镁投入到ng盐酸(过量)中,则:
Mg+HCl=MgCl2+H2↑
0.5mol 0.5mol
故溶液质量增重=0.5mol×24g/mol-0.5mol×2g/mol=11g,
由于m=n,则所得溶液质量相等,即a=b,
故答案为:a=b;
(3)标准状况下,448mL气体的物质的量为:$\frac{448×10{\;}^{-3}L}{22.4L/mol}$=0.02mol,该气体的摩尔质量为:$\frac{0.64g}{0.02mol}$=32g/mol,所以这种气体的相对分质量为32,
故答案为:32;
(4)根据溶液中阴阳离子所带的正负电荷总数相等,则有c(Na+)×1+c(Fe3+)×3=c(Cl-)×1,即:c(Na+)×1+0.2mol/L×3=1mol/L×1,解得:c(Na+)=0.4mol/L,故答案为:0.4mol/L;
(5)向某未知液中先滴加稀盐酸,无现象,说明不是碳酸根、亚硫酸根、银离子,再滴加氯化钡溶液,产生白色沉淀,则与钡离子形成白色沉淀,只能为硫酸根与其反应生成的硫酸钡,所以该澄清溶液中一定含有SO42-;
故答案为:SO42-.
点评 本题考查了氧化还原反应转移电子数的计算,物质的量的简单计算,电荷守恒的应用以及离子的检验,题目难度中等,培养了学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于57.3kJ | B. | 等于57.3kJ | C. | 小于57.3kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol•L-1•min-1 | B. | 0.04mol•L-1•min-1 | ||
| C. | 0.08mol•L-1•min-1 | D. | 0.4mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
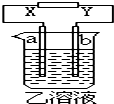 如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的( )
如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的( )| a极板 | b极板 | X电极 | 乙溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | Cu(NO3)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、Br-、SO42- | B. | Na+、Mg2+、Cl-、NO3- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | K+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓ | |
| B. | CO32-+2H+═CO2↑+H2O NaHCO3+HCl═NaCl+CO2↑+H2O | |
| C. | H++OH-═H2O 2HCl+Mg(OH)2═MgCl2+2H2O | |
| D. | Ba2++SO42-═BaSO4↓ BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
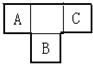 A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.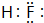 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com