I���跴Ӧ��Fe��s��+CO
2��g��?FeO��s��+CO��g����ƽ�ⳣ��ΪK
1����Ӧ ��Fe��s��+H
2O��g��?FeO��s��+H
2��g����ƽ�ⳣ��ΪK
2���ڲ�ͬ�¶��£�K
1��K
2��ֵ���£�
| T��K�� |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
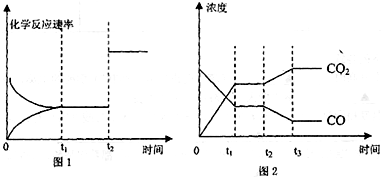
��1�����з�Ӧ��CO
2��g��+H
2��g��?CO��g��+H
2O��g��������һ��
��������š����ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ��
������ţ���
A����С��Ӧ�����ݻ� B������Ӧ�����ݻ� C�������¶�
D�������¶� E��ʹ�ú��ʵĴ��� F���跨����CO����
��2������ӦFe��s��+CO
2��g��?FeO��s��+CO��g�����¶�T
1�½��У�Fe��s��+H
2O��g��?FeO��s��+H
2��g�����¶�T
2�½��У���֪T
1��T
2����c��CO
2����c��H
2O����������������ͬ���������ߵķ�Ӧ����
������ţ���
A��ǰ�ߴ� B�����ߴ� C��һ���� D�����ж�
II����1�������ı��淢�������ڴ����dz��õķ�������������ƽ��Ҫ��Ӧ�ķ���ʽ��
Na
2FeO
2+
NaNO
2+
H
2O�T
NaFeO
2+
NH
3��+
NaOH
��2���������䡢ŨHNO
3�����ۻ����ܴﵽ����Ŀ�ģ���ͬŨ�ȵ�HNO
3������Ӧ�Ļ�ԭ����ܸ��ӣ���ֲ���������ͼ��
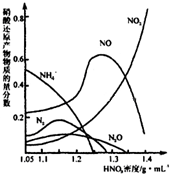
��ͼʾ��֪������HNO
3������Ӧ�Ĺ�����
��
�ڹ�ҵ��һ�㲻����Ũ������������洦��������ܵ�ԭ����
��
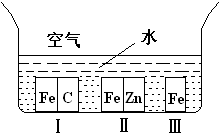
��3��������M���ĸ�ʴ����Ϊ������Ӧ��M-ne
-��M
n+�������������洦���ķ����⣬���з���Ҳ���������õ���
������ĸ��ţ�
A�������в�����Ƚ����Ƴɲ���� B��������Ʒ�����п
C��������к�̼�����Ƴ����� D����ˮ����բ����ֱ����Դ�ĸ���������



 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�

 A������ѡѧ����ѧ�������������
A������ѡѧ����ѧ�������������