
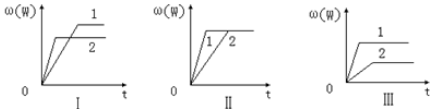
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
分析 图Ⅰ可能是不同压强、温度对反应的影响,如是压强,应有P2>P1,m+n<p;如是温度,应为T2>T1,△H<0;
图Ⅱ可能是在同温同压下催化剂对反应的影响,也可能是同温下改变压强的影响,应p1>p2,m+n=p;
图Ⅲ可能是不同压强、温度对反应的影响,如是压强,应有P1>P2,m+n>p;如是温度,应为T1>T2,△H>0,以此解答该题.
解答 解:A.图Ⅰ如是压强对反应的影响,则P2>P1,增大压强,ω(C)减小,说明平衡向逆反应方向移动,则m+n<p,故A正确;
B.图Ⅱ如是压强对反应的影响,则P1>P2,增大压强,ω(C)不变,平衡不移动,则m+n=p,故B正确;
C.图Ⅲ如是温度对反应的影响,应有T1>T2,升高温度,ω(C)增大,平衡向正反应方向移动,则△H>0,故C错误;
D.若m+n<p,△H>0,则该反应在高温下容易自发进行,故D错误;
故选AB.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意把握图象中曲线的变化特点,结合外界条件对平衡移动的影响分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
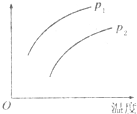 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ NH4+ Br- SO42- | B. | Na+ Fe2+ Cl- NO3- | ||
| C. | K+ Ba2+ Cl- NO3- | D. | K+ Na+ SO42- SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com