
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
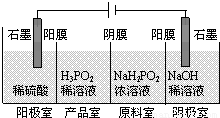
①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
在塑料袋中放一个成熟的苹果,再放些青香蕉,将袋口密封。两天后,发现青香蕉成熟了。导致青香蕉成熟的物质是成熟苹果释放出的 ( )
A.C2H4 B.CH3COOH C.C6H6 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下模拟考试理综化学试卷(解析版) 题型:选择题
某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol·L-1 NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B.加入CaCl2促进了HCO3-的水解
C.反应的离子方程式是2HCO3-+Ca2+==CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.0.01mol 甲基(—CH3)所含电子数为0.07NA
B.标准状况下,2.24L CH3Cl中所含分子数为0.1NA
C.常温常压下,0.1mol/L CH3CH2OH溶液中含有的碳原子数目为0.2NA
D.10 mL 0.1 mol/L HCHO溶液与足量的银氨溶液完全反应,转移电子的数目为2×10-3 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:选择题
下列关于化石燃料的加工说法正确的是
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:选择题
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
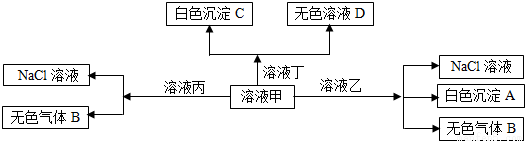
A.在甲中滴加丁可能发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O
B.溶液丙中还可以大量共存的离子有:I-、NO3-、SO42-
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:简答题
硫-氨热化学循环制氢示意图如下:
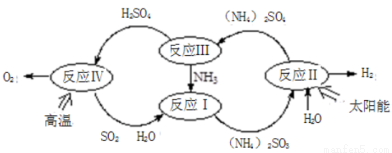
(1)反应Ⅱ是将太阳能转化为电能,再转化为化学能,电解池阳极的电极反应式 _______________;
(2)反应Ⅲ中控制反应条件很重要,不同条件下硫酸铵分解产物不同。连接装置A-B-C,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A 至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、B之间的导气管内有少量白色固体。经检验,该白色固体和装置B内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
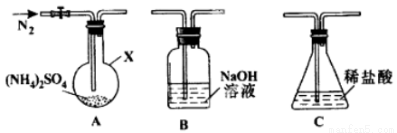
(NH4)2 SO4在400℃分解的化学方程式是:________________________________________;
(3)反应Ⅳ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O (l) △H=+462kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
iii.H2O(l)=H2O(g) △H=+44kJ/mol
①L(L1、L2),X可分别代表压强或温度。下图表示 L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
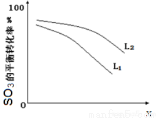
i.X代表的物理量是:________________,
ii.判断L1、L2的大小关系,并简述理由:________________________________________;
②反SO3分解的热化学方程式为:__________________________________________________;
(4)恒温密闭容器中,控制不同温度进行SO3分解实验。SO3起始浓度均为 cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。
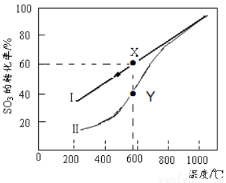
①图中点X点平衡常数:K=_____ ;
②Y点对应温度下的反应速率:v(正)______v(逆)(选填:>,<,=);随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
已知:25℃时Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的K比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小
C.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下期中化学试卷(解析版) 题型:选择题
下列物质的分子中,共用电子对数目最多的是 ( )
A.H2 B.NH3 C.H2O D.CH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com