
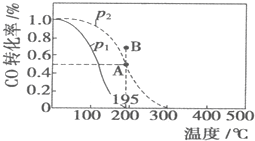
 ��20L�����ܱ������У������ʵ���֮��Ϊ1��2����CO��H2������CO��g��+2H2��g��?CH3OH��g����H=akJ/mol�����CO��ת�������¶ȼ���ͬѹǿ�ı仯��ͼ��ʾ��n��H2����P2��195��ʱ��ʱ��仯�����ʾ
��20L�����ܱ������У������ʵ���֮��Ϊ1��2����CO��H2������CO��g��+2H2��g��?CH3OH��g����H=akJ/mol�����CO��ת�������¶ȼ���ͬѹǿ�ı仯��ͼ��ʾ��n��H2����P2��195��ʱ��ʱ��仯�����ʾ| t/min | 0 | 1 | 3 | 5 |
| n��H2��/mol | 8 | 5 | 4 | 4 |
| A�� | P1��P2��a��0 | |
| B�� | ��P2��195��ʱ����Ӧǰ3min��ƽ������v��CH3OH��=0.08mol/��L•min�� | |
| C�� | ��P2��195��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25��mol/L��-2 | |
| D�� | ��B��ʱ��v����v�� |
���� ���ݻ�ѧ��Ӧ���ʺ�ƽ�ⳣ���Ķ�����м��㣬����Ӱ�컯ѧƽ������ؽ����жϵó���ȷ���ۣ������¶ȣ���ѧ��Ӧ���ʼӿ죬ƽ���������ȵķ����ƶ�������ѹǿ����ѧ��Ӧ���ʼӿ죬ƽ���������������С�ķ����ƶ���
��� �⣺A��P1ʱ�������¶ȣ�COת���ʼ�С��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����H��0���÷�Ӧ�����������С�ķ�Ӧ������ѹǿƽ�������ƶ���195��ʱ��COת����P2����P1��ѹǿ��P1�䵽P2��ƽ�������ƶ������P1��P2Ϊ����ѹǿ��P1��P2����A����
B.0��3 min��n��H2��=8-4=4mol����n��CH3OH��=4��2=2mol��v��CH3OH��=$\frac{\frac{2}{20}}{3}$mol•L-1•min-1=0.033mol•L-1•min-1����B����
C���ɱ�����Ϣ��֪����ʼʱ��c��H2��=$\frac{8mol}{20L}$=0.4mol/L��c��CO��=$\frac{1}{2}$c��H2��=0.2mol/L��ƽ��ʱ��c��H2��=$\frac{4mol}{20L}$=0.2mol/L��
CO��g��+2H2��g��?CH3OH��g��
��ʼŨ�ȣ�mol/L�� 0.2 0.4 0
ת��Ũ�ȣ�mol/L�� 0.1 0.2 0.1
ƽ��Ũ�ȣ�mol/L�� 0.1 0.2 0.1
K=$\frac{c��CH{\;}_{3}OH��}{c��CO��•{c}^{2}��H{\;}_{2}��}$=$\frac{0.1}{0.2��0.2��0.1}$=25L2•mol-2����C��ȷ��
D�����ݱ�������֪��ƽ��ʱ����ת����Ϊ50%�������淴Ӧ�г�ʼ��Ӧ�����ʵ���֮�ȵ����������֮��ʱ���䷴Ӧ��ת������ȣ����Ը��¶Ⱥ�ѹǿ��CO��ת����Ϊ50%������ͼ֪��A����ƽ��״̬��B��ת���ʴ���A�㣬�÷�Ӧ�ڸ��¶Ⱥ�ѹǿ�´ﵽƽ��״̬��Ӧ�����淴Ӧ�����ƶ�������B��v��������v���棩����D����
��ѡC��
���� ���⿼����������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�죬��ѧ��Ӧ���ʺ�ƽ�ⳣ���ļ��㣬Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ��������������Ŀ��飬ע�����ͼ��ķ��������⣬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����̿ | B�� | ���� | C�� | ���� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | x=1 | |
| B�� | ƽ��ʱA��Ũ��Ϊ1.5 mol/L | |
| C�� | B��ת����Ϊ20% | |
| D�� | ��Ӧ��ʼ�ʹﵽƽ��ʱ����������ѹǿ��Ϊ4��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
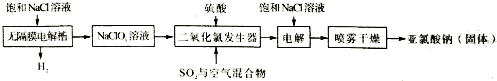
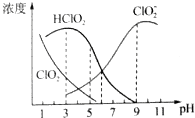
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
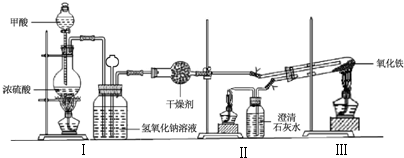
| ���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������% | |
| Fe | O | ||
| �ƾ��� | Fe��O | 74.50 | 25.50 |
| �����־ƾ��� | Fe��O | 76.48 | 23.52 |
| �ƾ���� | Fe | 100.00 | 0.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
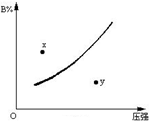 ��ӦmA���̣�+nB������?pC��������H��0��һ���¶���B�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ�������
��ӦmA���̣�+nB������?pC��������H��0��һ���¶���B�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ�������| A�� | m+n��P | |
| B�� | n��p | |
| C�� | x���ʾ�÷�Ӧ������Ӧ����С���淴Ӧ���� | |
| D�� | x���y��ʱ�ķ�Ӧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ����ͼ��ʾװ����ȡ������������ش��������⣺
����ͼ��ʾװ����ȡ������������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��֪ij��ȼ�Ϻ���̼���⡢������Ԫ�أ�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������������ȼ�գ���ʹ����������ȫ��ͨ����ͼ��ʾ��װ�ã��õ�������е�ʵ���������������������ȫ�����գ���
��֪ij��ȼ�Ϻ���̼���⡢������Ԫ�أ�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������������ȼ�գ���ʹ����������ȫ��ͨ����ͼ��ʾ��װ�ã��õ�������е�ʵ���������������������ȫ�����գ���| ʵ��ǰ | ʵ��� | |
| �������+U�ιܣ������� | 101.1g | 102.9g |
| ��ʯ��ˮ+���ƿ�������� | 312.0g | 314.2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com