
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①![]()
②![]()
则![]() 与
与![]() 反应生成两种无毒气体的热化学方程式为_____________。
反应生成两种无毒气体的热化学方程式为_____________。
(2)使用高效催化剂可大大减少汽车尾气排放出的![]() 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了![]() 时等质量的三种催化剂对
时等质量的三种催化剂对![]() 还原
还原![]() 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
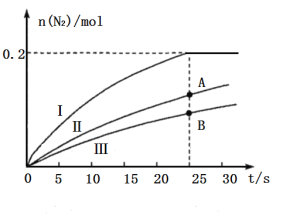
①如果不考虑催化剂价格,则使用催化剂______(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成![]() 的速率大小关系是___________。
的速率大小关系是___________。
②若容器容积为2L,开始时加入![]() 、
、![]() ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应![]() 在该温度下的平衡常数
在该温度下的平衡常数![]() ______
______![]() 。
。
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(![]() 转化率)与温度的关系图___________。
转化率)与温度的关系图___________。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:![]() ,其速率方程式为
,其速率方程式为![]() (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应![]() ,在温度低于
,在温度低于![]() 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为![]() ,则其两个基元反应分别为:Ⅰ.______
,则其两个基元反应分别为:Ⅰ.______![]() ______;Ⅱ.略,这两个反应中活化能较小的是__________。
______;Ⅱ.略,这两个反应中活化能较小的是__________。
②某科研小组测得![]() 时该反应的
时该反应的![]() 、
、![]() 生成
生成![]() 的速率
的速率![]() 的关系如下:
的关系如下:
| 0.025 | 0.05 | 0.025 |
| 0.04 | 0.04 | 0.12 |
|
|
|
|
则该温度下的反应速率常数![]() ______
______![]() 。
。
【答案】![]() Ⅰ
Ⅰ ![]() 640
640 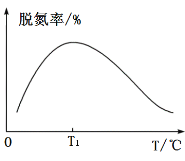
![]()
![]() Ⅱ 0.22
Ⅱ 0.22
【解析】
(1)根据盖斯定律进行求算;
(2)①由图1知,在相同时间内使用催化剂Ⅰ时生成的![]() 最多,故选用催化剂Ⅰ最好。由于使用催化剂Ⅱ的效果好于催化剂Ⅲ,即25s时A状态中
最多,故选用催化剂Ⅰ最好。由于使用催化剂Ⅱ的效果好于催化剂Ⅲ,即25s时A状态中![]() 、
、![]() 浓度比B状态的大,故A状态下逆反应速率较大,即生成
浓度比B状态的大,故A状态下逆反应速率较大,即生成![]() 的速率较大。②平衡时
的速率较大。②平衡时![]() ,
,![]() ,
,![]() ,故
,故![]() 。③相同时间内,在反应达到平衡状态前,反应速率越快,氮的去除率越高,达到平衡后,温度越高,越不利于反应向右进行,即氮的去除率降低,由此可作出相应的图像。
。③相同时间内,在反应达到平衡状态前,反应速率越快,氮的去除率越高,达到平衡后,温度越高,越不利于反应向右进行,即氮的去除率降低,由此可作出相应的图像。
(3)①由Ⅰ的![]() 知,反应物只有
知,反应物只有![]() 且化学计量数是2。Ⅰ是慢反应,则Ⅱ是快反应,活化能较小。②由表中数据知
且化学计量数是2。Ⅰ是慢反应,则Ⅱ是快反应,活化能较小。②由表中数据知![]() 时,该反应的反应速率与
时,该反应的反应速率与![]() 、
、![]() 的浓度成正比,即
的浓度成正比,即![]() ,由此可求出
,由此可求出![]() 。
。
(1) NO与CO反应生成两种无毒气体,应为CO2和N2,方程式应为2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g);
2CO2(g)+N2(g);
由已知:①2NO(g) ![]() N2(g)+O2(g) △H1=-180.5 kJ·mol-1;
N2(g)+O2(g) △H1=-180.5 kJ·mol-1;
②CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) △H2=-283 kJ·mol-1;
CO2(g) △H2=-283 kJ·mol-1;
根据盖斯定律可知①+②![]() 2可得2CO(g)+2NO(g)
2可得2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) △H=-180.5 kJ·mol-1+(-283 kJ·mol-1)=-746.5kJ kJ·mol-1;
2CO2(g)+N2(g) △H=-180.5 kJ·mol-1+(-283 kJ·mol-1)=-746.5kJ kJ·mol-1;
(2)①据图可知相同时间内使用催化剂I的反应最先达到平衡,所以使用催化剂I最好;据图可知A点曲线的斜率更大,反应速率更快,![]() ;
;
②据图可知25s时氮气的物质的量不再改变说明反应达到平衡,此时n(N2)=0.2mol,根据方程式可知此时容器中n(CO2)=0.4mol,△n(NO)=△n(CO)=0.4mol,初始投料为0.5molCO和0.5molNO,所以平衡时容器内n(NO)=n(CO)=0.1mol,容器的体积为2L,所以K=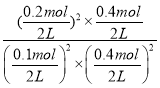 =640;
=640;
③温度低于T1时,反应速率小于T1时的反应速率,所以25s时反应达不到平衡,且温度越高反应速率越快,相同时间内脱氮率越高,当温度高于T1时,反应速率加快,则25s时反应达到平衡,但由于该反应正反应焓变小于0,为放热反应,所以温度升高,平衡左移,脱氮率会下降,所以关系图为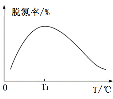 ;
;
(3)①温度低于250℃时,该反应的速率方程式为v=k·c2(NO2),说明NO2和CO不参与同一个基元反应,且NO2参与的基元反应为慢反应,决定了该反应的反应速率,基元反应I中产物有NO3,根据元素守恒可知该基元反应反应物应为NO2,则该基元反应I为:2NO2=NO3+NO; 活化能越大,反应速率越慢,基元反应I决定整个反应速率,说明反应I活化能较大,即反应II活化能较小;
②根据表格分析可知CO和NO2的浓度均会影响反应速率,由于该反应不是基元反应,可设该反应的正反应速率v=k·cx(NO2)·cy(CO),将表格中相应数据代入有
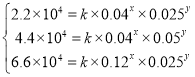
联立可解得x=1,y=1,k=0.22L·mol-1·s-1。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
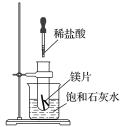
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
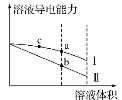
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为N2O4![]() 2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
2NO2 ,达到平衡时,四氧化二氮的转化率为__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
(2) 20 s时四氧化二氮的浓度c1=________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为________mol/(L·s)。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
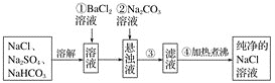
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com